Principios del asesoramiento genético y diagnóstico prenatal Dr. Francis H. Boudreau La disponibilidad de diagnóstico prenatal para una amplia gama de trastornos ha sido un avance importante en el ámbito de la genética reproductiva. La ecografía se ha jugado un papel central en el desarrollo de los diferentes enfoques para el diagnóstico prenatal. Además, la integración de un programa basado en la genética de diagnóstico prenatal mediante ecografía terciario se ha demostrado que aumenta la precisión del diagnóstico, en comparación con ultrasonido solo. El propósito de este documento se centra en la epidemiología de los defectos genéticos e incluir una descripción de los diversos procedimientos de diagnóstico prenatal en uso. Epidemiología Todos los embarazos tienen un riesgo basal de defectos de nacimiento. La mayoría de los genetistas una cifra de 3% a 4% para las malformaciones congénitas mayores. Es importante mantener esta cifra de referencia en mente cuando la terapia de pareja en relación con el riesgo de un defecto específico. La etiología de los defectos de nacimiento se puede dividir en 4 categorías:
Las malformaciones son defectos en la estructura de un órgano o región del cuerpo como consecuencia de un proceso intrínsecamente anormal del desarrollo. Estas malformaciones pueden ser únicas o múltiples, e incluyen, por ejemplo, defectos de nacimiento causados por defectos de un único gen. Deformaciones son anomalías en la forma, forma o posición causada por fuerzas mecánicas. Estas deformaciones se producen a menudo antes de nacer como resultado de moldeo intrauterina o restricción. Los factores que conducen a las deformaciones puede ser extrínseca o intrínseca. Alteración es un defecto morfológico resultante de la degradación de tejido previamente normal. Las interrupciones pueden ser causadas por fuerzas extrínsecas, la injerencia interna con un proceso de desarrollo o lesiones vasculares. Ejemplos de interrupciones incluyen amputaciones debido a las bandas amnióticas y gastrosquisis y porencefalia, tanto en pensamiento como resultado de la secuencia de insultos útero vascular. Es un patrón de múltiples anomalías resultantes de una anomalía única o principal factor mecánico, puede ser una malformación, deformación o interrupción. Un ejemplo es la secuencia de Potter, en el que por cualquier causa oligohydroamnios lleva a características similares de la compresión del feto: rasgos faciales característicos, posición anormal de las manos y los pies, y la hipoplasia pulmonar. Síndrome es un patrón de anomalías múltiples sabe que tienen una específicos comunes, etiología. Un ejemplo es el síndrome de Down, que es causada por la presencia de una copia adicional del cromosoma 21. Asociación se utiliza para identificar la existencia de dos o más características con más frecuencia de lo esperado por azar, pero que no se ha demostrado la etiología. Un ejemplo común es el VATER (vertebral, anal, traqueo-esofágica y anomalías renales) asociación. Este término no implica un diagnóstico específico, sino más bien le pide la búsqueda de otros defectos específicos cuando se identifica un componente de la asociación. I. anomalías cromosómicas: Los trastornos cromosómicos se producen en aproximadamente el 0,5% de los recién nacidos y es bien sabido que el riesgo para muchas anormalidades cromosómicas aumenta con la edad materna avanzada (1). Estudios sobre el origen prenatal del cromosoma 21 en el síndrome de Down han demostrado que el 95% de los casos de trisomía 21 se deben a no disyunción materna y sólo un 5% de los casos contienen un 21 paternales adicional. Aunque la edad de la madre está fuertemente correlacionada con el riesgo de síndrome de Down, la mayoría de los niños con síndrome de Down nacen de mujeres menores de 35 años. Muchas otras anomalías cromosómicas también se asocian con el aumento de la edad materna, incluidos los 13 y 18, 47, XXX, 47, XXY y 47, XYY. Anomalías cromosómicas estructurales, tales como las translocaciones y supresiones, así como el síndrome de Turner (45, X) no parecen estar relacionados con la edad. Las anomalías cromosómicas son la principal causa conocida de pérdida del embarazo, y al menos el 95% del cromosoma anormal concepciones se pierden antes de término. Se estima que un mínimo del 10% al 15% de las concepciones son anomalía cromosómica. Estudios de abortos involuntarios indican que alrededor del 50% de estas anomalías cromosómicas son las trisomías, el 20% son monosomías, el 15% son triploides, y el resto se tetraploides y anormalidades estructurales. Algunas de las anomalías cromosómicas, como la trisomía 16, son comunes en la concepción, pero nunca visto en niños nacidos vivos. Las anomalías cromosómicas en los nacidos vivos (2): 47, XYY 1 / 1080 nacimientos de varones 13 1 / 19, 000 T Robertsoniana (DQ; DQ) 1 / 1500 Robertsoniana 1 / 14, 000 II. Trastornos en un único Gen: Solo gen, o mendeliana, los trastornos se producen en aproximadamente el 1% de los recién nacidos. Un gran número de trastornos mendelianos se han descrito, aunque la incidencia de cualquier trastorno específico, en general, es raro. Por ejemplo, la fibrosis quística tiene una frecuencia de transmisión de aproximadamente 1 en 20, resultando en una frecuencia de la enfermedad de aproximadamente 1 en 1600. De los rasgos reconocidos solo gen, más de la mitad son autosómica dominante, aproximadamente un tercio son autosómica recesiva, y el resto son X-linked. Trastornos autosómica recesiva: se produce con más frecuencia en personas cuyos padres sanos ambos son portadores del mismo gen recesivo. El riesgo para los hijos de esos padres es de 25% en cada embarazo, y estos trastornos ocurren con más frecuencia, sin antecedentes familiares. Los trastornos autosómicos recesivos suelen ser graves, y muchos son los trastornos metabólicos. Las compañías de telecomunicaciones tienen en promedio 50% de la actividad enzimática. El mayor riesgo para los padres que son primos hermanos de tener un hijo con anomalías graves es de aproximadamente 6% o el doble de riesgo de fondo. Autosómica dominante Trastornos: las personas afectadas son heterocigotos para un alelo anormal, que transmiten el 50% de sus hijos, hombres o mujeres. Las personas no afectadas no transmiten la enfermedad. La edad de comienzo de muchos de estos trastornos es variable y las personas con un gen defectuoso, que por lo tanto destinado a desarrollar la enfermedad, puede ser asintomática hasta bien entrada la edad adulta. Personas en situación de riesgo puede tener sus propios hijos antes de la edad en la que se desarrollan los síntomas. La gravedad de muchas enfermedades autosómicas varía considerablemente, incluso dentro de una familia. La gravedad que pueda suponer descendencia afectada es difícil de predecir, y un padre con afectación leve pueden tener un hijo gravemente afectados. Nuevas mutaciones de enfermedades autosómicas dominantes parecen ser más comunes con el aumento de la edad paterna. Debido a la gran cantidad de condiciones autosómica dominante que pueden surgir de tales mutaciones, no hay pruebas prenatales específico disponible. En la neurofibromatosis aproximadamente el 50% de los casos se deben a nuevas mutaciones. En la acondroplasia, la forma homocigótica es letal y se puede prever que se produzca en el 25% de los casos con dos padres afectados. De crías, el 50% serán heterocigotos y afectados, y el 25% será normal. X-Trastornos relacionados: la mayoría de los trastornos ligados al X son recesivos, con hemicigotos (con sólo una copia del cromosoma X), los varones afectados y mujeres portadoras heterocigotos afectados. Una mujer portadora transmitirá el gen mutante y el 50% de su descendencia, por lo tanto, la mitad de sus hijos se verán afectados y la mitad de sus hijas serán portadoras. Un varón afectado pasará el cromosoma X mutante a todas sus hijas (que son por lo tanto obligar a los transportistas) y ninguno de sus hijos (que heredan sólo su cromosoma Y). La distrofia muscular de Duchenne pueden ser graves o mortales durante la vida temprana, de modo que los hijos de afectados no se reproducen. X-trastornos relacionados también puede ser dominante, aunque este tipo de herencia es mucho menos común. III. La Herencia Multifactorial: Defectos de nacimiento aislados, como el labio pie zambo, hendido y defectos del tubo neural (DTN) son algunas de las anomalías genéticas más comunes y son heredadas a través de una combinación de factores genéticos y ambientales. Algunos ejemplos de los rasgos hereditarios multifactoriales son: hydrocephly, defectos del tubo neural, labio leporino, con o sin paladar hendido, paladar hendido, anomalías cardíacas, hernia diafragmática, onfalocele, agenesia renal, los defectos de la fusión de Müller, defectos de reducción de las extremidades, estenosis pilórica y pie equino varo. El riesgo de recurrencia para los familiares de un miembro familiar afectado suele ser mayor que el riesgo de la población, con la mayoría de los trastornos multifactoriales, con un riesgo de recurrencia del 2% al 5% en familiares de primer grado. Este riesgo es mayor si se ven afectados más miembros de la familia. Hay también un riesgo mayor de enfermedades multifactoriales con consanguinidad de los padres. Los rasgos multifactoriales generalmente caen en una de las tres categorías siguientes: umbral de variable continua o trastornos complejos. Continua rasgos tienden a ser menos extremas en la descendencia de los individuos afectados, debido al principio estadístico de regresión a la media. Estos son típicamente medible o cuantitativa como los rasgos de altura o el tamaño de la cabeza, y se cree que el resultado de los efectos individuales pequeños de muchos genes en combinación con factores ambientales. Umbral rasgos no aparecen hasta un determinado límite de la responsabilidad que se supere. El labio leporino y el paladar y la estenosis pilórica son ejemplos de los rasgos de umbral. Los rasgos de cierto umbral tienen predilección por un sexo, lo que indica que los machos y las hembras tienen un límite de responsabilidad diferente. El riesgo de recurrencia para los rasgos de umbral también es mayor si el defecto es severo, una vez más que indica la presencia de genes anormales más o influencias. Por ejemplo, el riesgo de recurrencia tras el nacimiento de un niño con labio leporino y el paladar bilaterales es del 8%, en comparación con sólo el 4% después de labio leporino unilateral, sin el paladar hendido. Trastornos complejos de la vida adulta son los rasgos en el que muchos genes determinan la susceptibilidad de un individuo a factores ambientales, con la enfermedad resultante de la combinación más desfavorable de ambos. Esta categoría incluye a las enfermedades comunes, tales como enfermedad cardíaca y la hipertensión (3). IV. Teratógenos o exposiciones ambientales: Teratógenos o exposiciones ambientales se cree que causan anomalías congénitas en menos del 1% de los niños. Esta área es importante porque estas exposiciones son potencialmente prevenibles. Teratógenos incluyen los medicamentos, la exposición a agentes como la radiación ionizante, y por los productos de algunos trastornos maternos metabólicas como la diabetes y la fenilcetonuria. Para más detalles favor de revisar el capítulo sobre: Las drogas en el embarazo y la lactancia Indicaciones para el diagnóstico prenatal: Es esencial que las parejas en riesgo de ser informados de todas sus opciones reproductivas. Antes de intentar el diagnóstico prenatal de una enfermedad hereditaria, es esencial para establecer o confirmar la dirección hacia la eliminación de la posibilidad de un diagnóstico erróneo debido a la fenotípica, metabólicas, o la heterogeneidad genética. En el caso de un diagnóstico enzimático o molecular, el defecto precisos debe demostrarse en el probando o familiares afectados. De haber fallecido el individuo afectado, la heterocigosidad de ambos padres (o de la madre de una enfermedad ligada al cromosoma X) debe ser documentado. En el caso de síndrome dismórfico, todas las manifestaciones de la enfermedad debe ser conocida y buscó en el momento de la evaluación. Las indicaciones más comunes para estudios de diagnóstico prenatal son: edad materna avanzada, exámenes de laboratorio anormales; hijo con un trastorno cromosómico, portadora de la translocación equilibrada para un trastorno cromosómico; niño con un trastorno metabólico hereditario; parejas heterocigotos prospectiva detectado por los programas de cribado anterior hijo con un trastorno detectable por ecografía. Los trastornos multifactoriales: hijo con defecto del tubo neural; elevados en suero materno-alfa feto-proteína (AFP) y niño con defecto en el desarrollo o el síndrome de malformación detectable por ecografía. Defectos del medio ambiente: la exposición prenatal a las drogas teratogénicos o agente infeccioso. Usando una edad de la madre de 35 años en el momento de la entrega o más en el momento de la entrega como una indicación de pruebas invasivas (amniocentesis o muestreo de vellosidades coriónicas), aproximadamente el 20% de los casos de síndrome de Down será detectado. El 80% de los casos de síndrome de Down se producirá en la no probada grupo. En un esfuerzo por aumentar la tasa de detección del síndrome de Down, midtrimester detección bioquímica sérica materna ha sido desarrollado que detecta aproximadamente el 60% de los casos de síndrome de Down en la población general (4). Bioquímicos de detección de defectos de nacimiento: Algunos de los mayores avances de la genética durante las últimas dos décadas se han producido en el área de exámenes de laboratorio para detectar defectos congénitos en el feto. Un número de los marcadores bioquímicos han sido estudiados para su uso en el diagnóstico prenatal. Estos son: Alfa-Feto-Proteína (AFP): AFP es una proteína de onco-fetal, producida por el hígado fetal y el saco vitelino y es la proteína sérica importante en la vida fetal temprana. Inicialmente se entra en el líquido amniótico a través de la difusión a través de la piel del feto inmaduro y más tarde a través de la orina fetal. Las mujeres no embarazadas tienen niveles de AFP que son apenas detectable (1 U / L), mientras que los niveles normales de la mediana de 16 a 18 semanas de gestación entre 18 y 40 U / L. De suero materno AFP sigue aumentando hasta 28 a 32 semanas de gestación. En el feto con un defecto como la anencefalia o espina bífida-, AFP entra en el líquido amniótico en cantidades crecientes, lo que lleva a niveles más altos en el suero materno también. Los niveles de AFP son elevados en el líquido amniótico y en suero materno sólo cuando estas lesiones están "abiertos", es decir, cuando el tejido neural está expuesto o cubierto por sólo una fina membrana. Prácticamente el 100% de las lesiones de la anencefalia están abiertas; aproximadamente el 20% los casos de espina bífida son cerrados, al igual que aproximadamente el 82% de los casos de encefalocele (5). Los debates de la sensibilidad y la especificidad de las pruebas de AFP están restringidas generalmente a lesiones abiertas, como se supone que las lesiones cerradas no será detectado. En los laboratorios de prestación de control de la AFP, los resultados se expresan como múltiplos de la mediana (MoM), que permite la expresión de las mediciones en una forma común. La distribución de suero materno AFP (MSAFP) es log-Gaussiana, con valores promedio de 1,0 para los embarazos normales, 3,8 para los embarazos con espina bífida abierta, y 6,5 para los embarazos afectados con anencefalia. Los dos puntos de corte más comúnmente utilizados para MSAFP son 2,0 y 2,5 mamá. En 2,0 MoM los intervalos de porcentajes de falsos positivos del 4% al 6%, y la tasa de detección de la espina bífida abierta oscila entre el 85% al 90%. Con un mayor punto de corte de 2,5 MoM de falsos positivos disminuye la tasa al 2% al 3% y la tasa de detección también disminuye al 75% a 80%. Las mujeres con pre-diabetes gestacional tienen valores MSAFP que el promedio de un 20% menor en el segundo trimestre. Cuando el nivel de MSAFP está por encima del punto de corte (2,0 o 2,5 MoM) la exactitud de las citas se evalúa. Si la data se basa en el último período menstrual fue utilizado para el cálculo original, y la ecografía debe realizarse para la fecha exacta. La amniocentesis puede ser indicado para identificar la causa de la AFP elevado. Causas de un MSAFP elevada: gestación múltiple, muerte fetal, la hemorragia feto-materna, anormalidades en la placenta, malformaciones uterinas, tumores de ovario materno o hepática. Fetal, defectos estructurales: los defectos del tubo neural --espina bífida, anencefalia, encefalocele, abierto defectos de la pared ventral - onfalocele, gastrosquisis, nefrosis congénita; triploidía, agenesia renal bilateral, trastornos de la piel congénita - epidermólisis ampollosa, aplasia cutis; poliquística autosómica recesiva enfermedad del riñón; teratoma sacrocoxígeo; malformación adenomatosa quística del pulmón. Triple marcador de detección: Un número de otros marcadores bioquímicos han sido estudiados para la detección del aneuploidía. Tanto el estriol no conjugado (uE3) y la gonadotropina coriónica humana (hCG) agregar la especificidad y la sensibilidad a la detección segundo trimestre bioquímicas del síndrome de Down. Triple detección de marcadores con la AFP, UE3, y hCG se ofrece rutinariamente durante el embarazo. La mayoría de los centros de usar un 1 / 270 de riesgo de síndrome de Down en midtrimester como punto de corte por encima del cual se ofrece la amniocentesis, este riesgo es equivalente a la de un 35-year-old woman. Al igual que con AFP, el peso materno, la raza, la diabetes, y el número de fetos presentes se consideran en el cálculo del riesgo. Toma de muestras de ADN de tejido fetal y Metodología: Algunas enfermedades hereditarias sólo se expresan en un tejido específico, y por lo tanto toma de muestras de tejido que es necesario si el diagnóstico prenatal se debe hacer. Hígado del feto, la piel del feto y del músculo fetal se han obtenido por biopsia guiada por ultrasonidos (6). Medida que se avance en el esclarecimiento de los defectos moleculares específicos en un número cada vez mayor de enfermedades genéticas, el diagnóstico prenatal será posible mediante el análisis de ADN. Ya que el ADN está presente en todas las células nucleadas, las técnicas mínimamente invasivas como la amniocentesis o el muestreo de vellosidades coriónicas pueden sustituir los procedimientos más invasivos como la toma de muestras de sangre fetal o una biopsia de hígado fetal para el diagnóstico prenatal de muchas enfermedades. Ultrasonido de Evaluación de anomalías cromosómicas Durante la última década y media, el campo de la ecografía genética ha surgido. Hace quince años, la amniocentesis se reservó para las mujeres de edad materna avanzada, resultando en la posibilidad de identificar a menos de la cuarta parte de los fetos aneuploidía. Ahora, la decisión de si un paciente está en riesgo de aneuploidía fetal se basa en la combinación de la edad materna, los marcadores bioquímicos de múltiples y una completa evaluación ecográfica del feto. Tal vez con este método combinado, vamos a avanzar desde la identificación de potencial de 20% de los fetos con síndrome de Down (es decir, aquellos asociados con una edad materna superior a 35 años) que la tasa de detección posible de 90% de los fetos con anomalías cromosómicas, recomendando al mismo tiempo amniocentesis a sólo el 5% al 10% de las mujeres embarazadas. Guiada por ultrasonido obstétrico Procedimientos de diagnóstico El síndrome de Down es la anormalidad cromosómica más común entre los recién nacidos vivos y también ha demostrado el síndrome más ecográficamente difícil de todos los síndromes de trisomía autosómica. Parece lógico, sin embargo, que el examen ecográfico del feto sí mismo para reconocer las características de los niños con síndrome de Down, sería aún más sensible y específico para la detección de los fetos afectados que son la edad materna y el examen de suero. Ecográfica de detección de Síndrome de Down Marcadores ecográficos de aneuploidía:Segundo trimestre los exámenes ecográficos son a menudo de forma rutinaria para detectar anormalidades anatómicas fetales, las conclusiones de una anomalía grave o dos o más malformaciones menores estructurales aumenta el riesgo de aneuploidía y garantiza el asesoramiento genético y el examen de la amniocentesis (7). Una serie de anomalías fetales estructurales y no patológicos (o "suave") marcadores detectables en el examen ecográfico del segundo trimestre también se han asociado con el síndrome de Down. Los estudios han demostrado que el segundo trimestre de examen ecográfico puede identificar 50 a 75% de los fetos con síndrome de Down, a las tasas de detección positiva de 4 a 15%. Sin embargo, los resultados de las pruebas depende de la población de estudio, la elección de los marcadores, la edad gestacional, y la experiencia del ecografista. Un enfoque común es usar los cocientes de probabilidad para los marcadores ecográficos (calculado dividiendo la sensibilidad de la tasa de falsos positivos), a fin de calcular el riesgo de una mujer de tener un feto con síndrome de Down, el riesgo según la edad de la madre o de detección del suero se multiplica por el cociente de probabilidad (8). En un estudio prospectivo, la población de estudio de cohorte basado en la participación de mujeres con resultados del cribado sérico que indica un mayor riesgo de síndrome de Down, la presencia de anomalías estructurales o un engrosamiento de la nuca veces mayor el riesgo de síndrome de Down en un factor de nueve años, y la ausencia de anomalías redujo el riesgo en un tercio. Cuando los marcadores blandos fueron detectados en relación con una anomalía estructural, el riesgo de síndrome de Down se incrementó, mientras que el hallazgo de marcadores solo suave (sin incluir el grosor nucal veces) no cambia sustancialmente el riesgo. La importancia de los marcadores blandos detecta en un examen ecográfico de rutina en 20 semanas de gestación en un paciente que por lo demás parece estar en bajo riesgo de dar a luz a un niño con trisomía 21 o trisomía 18 es incierta, y la preocupación es que la presencia de estos marcadores pueden dar lugar a procedimientos invasivos de diagnóstico que son innecesarias. Por el contrario, un examen de ultrasonido normal puede dar falso consuelo a los pacientes con un riesgo que se incrementa en función de los marcadores séricos o edad. En el primer trimestre, la no visualización del hueso nasal en el examen ecográfico se ha asociado con un mayor riesgo de síndrome de Down y otras aneuploidías. Cuando se utiliza con la evaluación del primer trimestre combinada en pacientes con riesgo aumentado a causa de la edad materna (edad media 35 años), y la tasa estimada de detección de la trisomía 21 fue de 93% a una tasa de detección positiva del 5% (9). Evaluación del hueso nasal, se ha incorporado en los algoritmos de detección en algunos centros, pero debe ser realizado solamente por ultrasonographers capacitado. Los hallazgos ecográficos en la trisomía 21:Las anomalías estructurales: defectos cardíacos; higromas quística; atresia duodenal; ventriculomegalia. No hallazgos patológicos, o "marcadores blandos": grosor nucal veces (> 6 mm); hueso nasal hipoplásico o ausente; quiste plexo coroideo; foco ecogénico intracardiaco; pyelectasis renal; húmero corto, fémur corto, intestino ecogénico, cordón umbilical con dos buques, hipoplasia de la falange media del dedo quinto dedo del pie de sándalo brecha (la separación del dedo gordo) 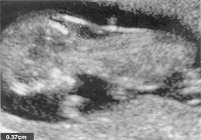 El aumento de medición de la translucencia nucal de 3,7 mm a las 12 semanas en un feto con síndrome de Down Otros marcadores ecográficos del primer trimestre de investigación (por ejemplo, el ductus venoso en las imágenes de Doppler, insuficiencia tricúspide fetal anormal y fronto-maxilar y los ángulos de la mandíbula superior), no se utilizan generalmente en los algoritmos de detección en la práctica habitual (10). Requisitos previos para el uso más generalizado de estas medidas incluyen la evaluación de poblaciones de bajo riesgo, la utilización de los datos sobre la edad gestacional y las normas que son específicas a la raza del paciente o grupo étnico, la adopción de un enfoque estandarizado, la formación adecuada, y la aplicación de la calidad los programas de evaluación. Resumen: Ultrasonido seguirá desempeñando un papel fundamental en el desarrollo de estos nuevos enfoques para el diagnóstico prenatal y terapia fetal. La disponibilidad de principios del primer trimestre, el diagnóstico prenatal puede proporcionar oportunidades para el tratamiento prenatal de algunos trastornos en reemplazo de las enzimas o cofactores, en reemplazo de genes somáticos, o con el transporte de células madre. El acceso seguro y fiable a la circulación fetal se está abriendo una nueva era en el diagnóstico prenatal del feto y la terapia fetal. Referencias
|