Периодические потери беременностиБюллетень WHEC Практика и клинической управления для медицинских работников. Образование гранта, предоставленного здоровья женщин и образовательный центр (WHEC). Периодические потери беременности (РПЛ) является разочарование проблема как для пациентов и врачей. Самопроизвольный аборт или выкидыш определяется как потери беременности до 20 недель беременности или плода весом 500 г и менее. Беременность является сложный процесс, включающий множество сложных взаимодействий между плода и материнской среды. Беременность может привести к потере из любого количества генетических, анатомических, эндокринную, иммунную или тромботических нарушений, а также от неизвестных причин (1). Несмотря на всестороннюю оценку, причиной рецидивирующего потери беременности (RPL) не может быть идентифицировано более половины пострадавших пар. Осторожные уверенность и поддержку важны - как и тщательный мониторинг. Периодические потери беременности (RPLs) не означает неизбежности. Даже тогда, когда пациенты RPLs без известной этиологии, будущие результаты не могут быть плачевными. При рассмотрении вопроса о вероятности потери беременности вне зависимости от конкретного диагноза, женщина, которая не имела потерь с беременностью имеет 15% вероятность потери при следующей беременности. Для женщины с одним необъяснимым до потери, риск потерь при следующей беременности повышается до 13%, и до 30% с двумя необъяснимые потери. Даже с пациентами, у которых были четыре до потери беременности, однако, возможность проведения следующей беременности до срока 60% (2). Наиболее важными аспектами управления больных с RPL частые общения, воспитания, и эмоциональную поддержку. Осторожные уверенность должна быть предложена, как большинство и около 70% пациентов в конечном итоге обеспечить успешную беременность. Тщательный контроль является оправданным, потому что женщины с RPL также подвергаются повышенному риску других осложнений беременности, таких как преждевременные роды и внематочной беременности. Цель этого документа заключается в определении причин рецидивирующего потери беременности (RPL) и их потенциальных методов лечения, где это применимо. Человеческого воспроизводства неэффективный процесс. Только 15% до 30% оплодотворенных яйцеклеток приводит к жизнеспособной беременности. После полной оценки и успешного лечения, пары, которые испытали спонтанный аборт, часто боятся забеременеть снова. Эти пациенты нуждаются в интенсивной поддержке врач во время первого триместра беременности. Этот обзор может служить полезным источником информации при консультировании пациентов относительно вариантов лечения. ОпределениеПериодические потери беременности (RPL) в настоящее время определяется как три или более последовательных потери беременности клинически признанных беременности до 20 недель беременности (за исключением - биохимические, внематочной и молярной беременности). Около 2% женщин имеют два последовательных потерь беременности. Традиционно, RPL, которая затрагивает приблизительно 1% пар, относится к потере подряд три или более беременностей. Тем не менее, риск потери третьим после двух выкидышей составляет около 30%, тогда как риск потерь после трех составляет около 33% (3). Потому что эта разница очень мала, многие врачи начнут оценки RPL после двух поражений. Этот подход может быть особенно полезным у пожилых женщин. Первичная RPL относится к пациентам, которые никогда не достигнут беременности, в то время как вторичный RPL относится к тем, у которых выкидышей следуют по крайней мере одна нормальная беременность. Риск выкидыша ниже у женщин, которые несут по крайней мере одну беременность, в то время как история выкидыша увеличивается вероятность выкидыша при последующих беременностях. Возраст матери также сильным предиктором периодические потери. ЭпидемиологияИз клинически беременностей, 10% до 15% приводит к спонтанным абортам. Большая часть этих потерь беременности клинически очевидной беременности 12 недель. Эмбриональные или предварительно эмбриональной смерти обычно происходит по крайней мере за 1 неделю до клинических признаков потери беременности быть узнанным. Риск RPL Раньше считалось, прогрессивно увеличиваться с каждым самопроизвольного аборта и в результате женщина, имея 80% вероятность последующего спонтанного аборта после трех самопроизвольные аборты. В настоящее время считается, что спонтанные риск возрастает с увеличением числа беременных потери, но очень постепенно, и редко превышает 40% до 50%. Для женщины, которая была живорождения, даже если у нее было несколько спонтанных абортов, ее риск самопроизвольного выкидыша при последующих беременностях составляет 30% в беременности (4). Этиология и факторы рискаСледующие причины RPL широко приняты. Проработка RPL отрицательное в более чем 50% пациентов (5). Тем не менее, успешная беременность наступает у 35% до 80% пар, которые были оценены по RPL, независимо от этиологии и лечения (5). Пары с необъяснимым RPL имеют еще более высокие шансы на успешную беременность. Этиология Периодические потери беременности
Факторы риска:
Диагностика и лечениеСуществует никаких конкретных число потерь или твердо установленных критериев, судей оценки для RPL или определяет объем тестирования. Решения должны быть индивидуализированы и рассмотрение возраст женщины, времени и обстоятельств ранних потерь беременности, элементы личной и семейной истории болезни, и уровень пары тревоги должны быть приняты во внимание. Клиническое обследование и лечение может быть рассмотрен в пары с двумя последовательными спонтанной потери, когда любой из следующих присутствуют: эмбриональной сердечной деятельности наблюдается в более ранние потери беременности; нормальный кариотип на продукты зачатия от ранее потери, возраст> 35 лет; и бесплодие . Хромосомные аномалииХромосомные аномалии встречаются у 64% до 88% от изолированной самопроизвольные аборты (5)(6). Из них 62% до 70% аутосомно трисомии, 8% до 20% триплоидных или тетраплоидных, и 6% связаны с хромосомными структурные аномалии. Распространенность хромосомных аномалий в РПЛ, по крайней мере 50% и, как правило, связанные с возрастом матери. У пациентов, перенесших экстракорпоральное оплодотворение (ЭКО), предимплантационной неудачи связаны с хромосомными аномалиями в 67% до 85% случаев (7). Предимплантационная кариотипирование эмбрионов от периодических пациентов абортов демонстрирует в шесть раз увеличилась скорость monosomies. Периодические анеуплоидии (аномальное количество хромосом) может быть доказана в более чем две трети от последующих беременностей после постановки диагноза в первую беременность. Этиология хромосомные аномалии не совсем понятны. Нарушения, возникающие в ходе первого мейотического счет разделения для большинства анеуплоидии. Точный механизм, с помощью которой это происходит, находится под следствием. Генетические факторы, которые зависят от возраста, например, хрупкие участки на хромосомах, инверсии, транслокации и, составляют 3,5% до 4,4% от RPL анеуплоидии. Из них транслокаций чаще всего встречаются в РПЛ. Существуют два основных типа транслокаций: взаимные, в котором два сегмента из разных хромосом происходит обмен, и робертсоновских, в котором есть синтеза в центромеры двух акроцентрических хромосом. Сбалансированные транслокации может привести к нормальной носителей, но может привести к несбалансированным перестановок в потомство и тем самым выкидыш. Беременность потери чаще встречается с материнской транслокации. Частота и распределение хромосомных аномалий в клинически Человеческие представления (8):
Факторы маткиВрожденные и приобретенные аномалии матки счета на 10% до 15% женщин с RPL и идентифицируются sonohysterography (ГВГ) или гистеросальпингографии (ГСГ) (9). Магнитно-резонансная томография (МРТ) может потребоваться точно дифференцировать перегородкой и двурогий матки. Мюллеровых тракта Нарушения: Врожденные аномалии мюллеровых проявляется тракта, а спектр результатов, от частичной перегородками с полным дублированием верхних дыхательных репродуктивного (см. рисунок ниже). Перегородкой матки является наиболее распространенной аномалией мюллеровых, наиболее тесно коррелирует с потери беременности (65% спонтанных абортов), а также пороков развития наиболее легко и успешно корректируется гистероскопической пластика носовой перегородки. Маточные didelphys и двурогий матки связаны с примерно 40% спонтанных абортов. Тем не менее, брюшной процедур metroplasty редко показан для женщин с маткой didelphys или двурогий матки. Серкляж может способствовать улучшению исходов беременности у женщин с двурогий матки и в тех, с unicornuate матки или матки didelphys которые имеют историю previable доставки или выставку прогрессивных шейки сокращение на ранних стадиях беременности. 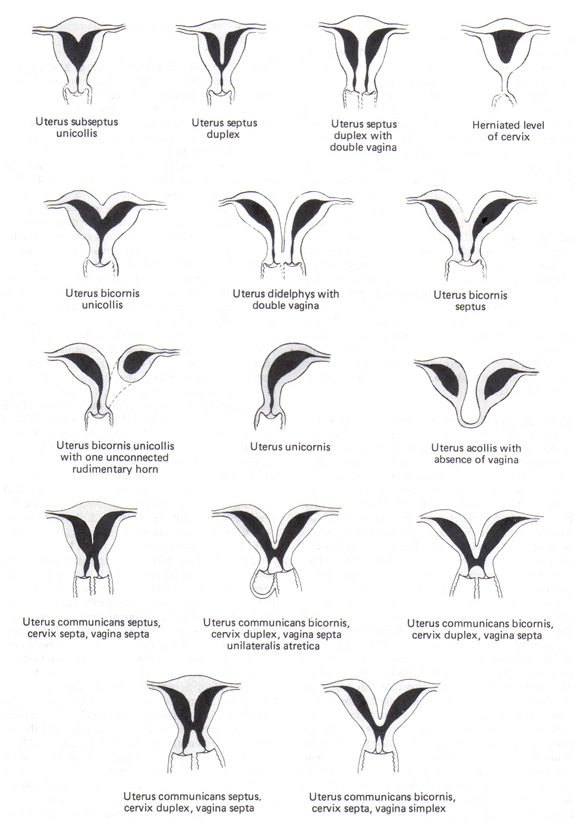 Рисунок 1. Врожденные аномалии матки Миома матки и другие анатомические факторы: миома матки часто считаются у женщин с РПЛ, но только в подслизистом миомы и больше очной миомы, что посягать на или исказить полость матки являются существенными. Внутриматочные спайки редко, но установленной причиной RPL, с улучшением исходов беременности после гистероскопии лизиса. Наконец, хотя diethylstilbesterol (DES) был запрещен в 1971 году, пострадавших женщин по-прежнему время от времени видел. Около 70% женщин, подвергшихся воздействию DES внутриутробно имеют аномалии развития матки и два раза повышенный риск самопроизвольного аборта, около 24% (10). Серкляжа следует рассматривать у женщин с историей DES экспозиции и вторая потеря триместра или преждевременных родов. Инфекционные заболеванияХотя инфекция является частой причиной бедных последний исход беременности во время беременности, не соответствует связь между инфекциями и RPL была продемонстрирована. Ни хламидий ни Mycoplasma видов, распространенных причин преждевременных родов и других осложнений после первого триместра беременности, была окончательно определена как причина САП. Это могут быть, однако, связан с единовременной или спорадические потери беременности. Рутинное серологических тестов, рак шейки культур, и биопсия эндометрия для выявления генитальных инфекций у женщин с RPL, не оправдались. Оценка для инфекции должно быть ограничено женщин с цервицита, хронического или рецидивирующего бактериального вагиноза, или другие симптомы инфекции органов малого таза. Эндокринные причиныЭндокринные нарушения являются сравнительно редко причиной RPL, но включают в себя: сахарный диабет, заболевания щитовидной железы субклинического, синдром поликистозных яичников (СПКЯ), гиперпролактинемия и лютеиновой фазы дефектов. Оценка глюкозы в крови и уровень гемоглобина A1C показан для женщин с известной или подозреваемой сахарным диабетом, но в остальном не оправдано. Установлено, что хорошо контролируемым сахарным диабетом не повышает риск самопроизвольного аборта. Заболевания щитовидной железы легко выявлять и лечить и должны быть исключены тиреотропного гормона (ТТГ) измерения, и даже тонкие нарушения могут повлиять на исход беременности, хотя есть споры, если есть истинное отношение к САП. Инсулинорезистентность также связано с RPL и СПКЯ было связано с самопроизвольным абортом. Это может быть опосредовано через нарушение фибринолитической ответ, как свидетельствует тот факт, что женщины с СПКЯ и RPL имеют повышенный уровень ингибитора активатора плазминогена-1 (PAI-1) (11). Повышенный уровень PAI-1 может препятствовать имплантации трофобласта и инвазии посредничестве урокиназы типа активатора плазминогена. Другие потенциально эмбриотоксическое факторов, как в избытке в фолликулярной жидкости СПКЯ пациента включают глюкозу, инсулин-подобный фактор роста-1 (IGF-1), и уровня андрогенов. СПКЯ только не предсказывают риск выкидыша. Тем не менее, ожирение независимо связаны с беременностью потери. Ретроспективные и малых случай-контроль, исследования показали, что терапия метформином снижает риск ПРЛ у женщин с СПЯ с 42% до 62% до 26% до 29% (11). Большие проспективные исследования, необходимые для подтверждения этого объединения. Повышенный уровень пролактина связывают с RPL, и лечение с бромокриптина было показано, что повышает вероятность нормальной беременности. Лютеиновая Дефекты фазыЗаболеваемость лютеиновой фазы дефект - проверено на биопсию эндометрия, демонстрируя отсутствие прогестерона эффект ожидается в цикле - то же для женщин детородного возраста, как для людей с историей бесплодия (12). Поэтому, несмотря на разумную теорию, что дефект лютеиновой фазы потенциальной причиной RPL, так же, как это диагноз остается неопределенным. Распространенность лютеиновой фазы дефекта, в которой есть относительный дефицит прогестерона, составляет 2,5% в РПЛ пациентов (12). Хотя большая часть имеющейся литературы была противоречива, Кокрановского обзора 15 рандомизированных контролируемых исследований сделан вывод, что, начиная дополнительного прогестагена в первом триместре беременности улучшает исходы у пациентов с рецидивирующим, но не изолированы, потери беременности в первом или втором триместре (13 ). Учитывая данные, указывающие на выгоду для женщин с во втором триместре потери, и к этому времени плацента взяла на себя роль секретирующие прогестерон, теория позади эффективности прогестерона в этот параметр является его действие как гладкомышечных релаксантов. Пути введения и дозы прогестагенов разнообразны в обзор исследований. Некоторые ЭКО исследования показывают, что оральный прогестаген уступает внутримышечного формулировка (14). Особенно с бесплодием населения, очень важно с раннего добавок не начинать слишком рано. ЭКО данные показывают, что эндометрий чрезвычайно ускоренный может фактически снизить уровень имплантации эмбриона. Поэтому, когда добавок обеспечивается, прежде чем положительный результат теста на беременность, пациент должен быть мониторинг овуляции. Для пациентов с RPL, конечно, если это произошло в первом триместре - добавки следует продолжать как минимум до гестационного возраста 9 недель. Имплантация происходит примерно через неделю после овуляции, но есть свобода в выборе времени. Иногда пациенты забывают принимать их прогестагена добавок позднее в цикл, и никакой разницы в наступления беременности не отмечено. Лечение лютеиновой фазы дефекта Прогестерон вагинальные суппозитории: 25 мг дважды в день, начиная через 3 дня после лютеинизирующего гормона (ЛГ) от всплесков напряжения и продолжается до 8 недель беременности; Прогестерон в масле внутримышечно (IM): 12,5 мг / сут IM начале 3-х дней после того, выброс ЛГ и продолжается до 8 недель беременности; Микронизированный прогестерон: 200 мг / сут в рот начале 3-х дней после того, выброс ЛГ и продолжается до 8 недель беременности; Кломифен цитрат: 50 мг / сут внутрь в течение 5 дней, начиная с 3-5 дня менструального цикла (без добавок беременности необходимо). Иммунологические факторыОба аутоиммунных и аллоимунный механизмы вовлечены в качестве причин САП. Аутоиммунные расстройства включают иммунный ответ направлен против определенной части хоста или самостоятельно. Аллоимунный расстройства связаны с ненормальной материнской иммунной реакции на плод или плацентарных антигенов, включая материнскую цитотоксические антитела, отсутствие материнской блокирующие антитела, и нарушения в естественной функции клеток-киллеров и дистрибуцию. Аутоиммунных заболеванийАутоиммунные заболевания, такие как системная красная волчанка (СКВ) и антифосфолипидным синдромом (ППНМ) можно идентифицировать и лечить расстройства и связанные с САП. Волчаночного антикоагулянта и антител к кардиолипину, наиболее широко признанных антител клинического использования, и были связаны с различными медицинскими проблемами, в том числе артериальных и венозных тромбозов, аутоиммунных тромбоцитопении, и гибели плода (15). В дополнение к гибели плода, некоторые акушерские осложнения были связаны с наличием антифосфолипидных антител, в том числе преэклампсии, внутриутробной задержки роста, плацентарной недостаточности и преждевременных родов. Антифосфолипидный синдром (ППМ)Антифосфолипидный синдром (ППНМ) является аутоиммунным заболеванием определяется наличие характерных клинических признаков и специфических уровней циркулирующих антифосфолипидных антител. Поскольку около 70% лиц с ППМ являются женщинами (16), имеются достаточные основания распространена среди женщин репродуктивного возраста. Антифосфолипидных антител представляют собой разнородную группу антител со специфичностью для связывания с белками отрицательно заряженными фосфолипидами на поверхности клеток. Несмотря на распространенность и клиническое значение ППНМ, расхождения во мнениях относительно показаний к ППМ испытаний и тестов, которые должны быть упорядочены, чтобы диагностировать состояние. Большая часть дебатов результаты из-за отсутствия хорошо разработанных и контролируемых исследований по диагностике и лечению противопехотных мин (17). Первичный антифосфолипидный синдром относится к пациентам с противопехотных мин, но не других признанных аутоиммунные заболевания (18). Тем не менее, других аутоиммунных заболеваний, таких как СКВ, часто сосуществуют с условием. Когда это происходит в обстановке другие аутоиммунные заболевания, то речь идет как вторичный антифосфолипидный синдром(18). Определенные ППМ считается настоящим, если хотя бы одна из клинических критериев и одного из лаборатории критериям (17): Клинические Акушерские:
Сосудистый тромбоз:
Лаборатория
Управление противопехотных мин во время беременности: цели лечения для противопехотных мин во время беременности, для улучшения здоровья матери и плода, новорожденных результат, снижая риск потери беременности, гестоз, плацентарная недостаточность, и преждевременных родов и по сокращению или ликвидации материнской тромботических рисков. Два последних обзоров (19) подчеркивают, что ряд случаев заболевания и лечения испытаний, как правило, включают лиц, чьи ППМ диагнозом попадает в одну из двух групп: с историей тромбообразования и без истории. Лечение женщин с ППМ без тромботических событий, является спорным. Недавно проведенный мета-анализ показал, что для женщин с повторными выкидышами в качестве клинических критериев, профилактических гепарина и низких доз аспирина может снизить потери беременности на 50% (20). Это комбинированная терапия представляется превосходят низкие дозы гепарина в одиночку или преднизолон. Для женщин с ППМ без истории тромботические события, некоторые врачи рекомендуют начала гепарина до зачатия, хотя никаких клинических испытаний поддерживает эту рекомендацию. Большинство экспертов рекомендуют 6-8 недели послеродового тромбоза у женщин с акушерской противопехотных мин (21). Несколько подходов к дородовой и послеродовой управления антикоагулянтной терапии для таких пациентов имеются. Управление в нашем институте есть:
Лечение может быть начато после зачатия, чтобы документально жизнеспособность, не обнаружено различий в исходах (22). Другие методы лечения, которые были предложены для лечения беременных женщин с ППМ включают кортикостероиды и внутривенного иммуноглобулина (ВВИГ). Несколько серий случаев сообщают 60-70% количество успешных беременностей у женщин с ППМ получавших преднизолон и низких доз гепарина (22). Потому что эффективность ВВИГ не было доказано в специально спланированных исследований и препарат очень дорогой, это не рекомендуется в качестве первичной терапии. Аллоимунный расстройствПринятие плода и плаценты аллотрансплантата по материнской иммунной системы приводит из трофобласта выражение неиммуногенным HLA-G, Fas лиганда; иммуносупрессивных препаратов, таких как ХГЧ, PAPP-A, и прогестерон, а также ростом материнской уровни кортизола. HLA обмена между мужем и женой была теоретически привести при отсутствии беременности специфические антитела, которые защищали половины иностранных плода от материнского отказа. Тем не менее, все существующие методы для оценки предполагаемых alloimmunopathology, в том числе HLA тестирования, оценки иммунной клетки (смешанная культура лимфоцитов, естественных клеток-киллеров анализов) и цитокинов тестирования исследуемого. Ни один из двух основных иммунотерапии выступает за лечение аллоимунный расстройств у женщин с RPL, отчего лейкоцитов иммунизации и IV иммуноглобулина, были доказали свою эффективность (23). Унаследованные тромбофилииУнаследованные тромбофилии в результате генетической мутации факторов свертывания крови приводит к тромбозу плацентарных возникли как потенциально важной причиной RPL (24). Тем не менее, большинство женщин с этими мутациями имеют совершенно нормальные репродуктивные исходы. Женщины с более чем одним типом мутаций или чей плод наследует мутации могут быть подвержены большему риску выкидыша. Показания для скрининга женщин с RPL для растущего числа признанных тромбофилии еще не установлены. В настоящее время скрининг кажется подходящим для женщин с каким-то необъяснимым RPL с подозрительным потерь (после 10 недель беременности или обнаружения эмбриональной сердечной деятельности) или истории других осложнений беременности, которые могут быть результатом тромбоза или плацентарной недостаточности (преэклампсии, внутриутробной задержки роста, отслойка плаценты). В дополнение к волчаночного антикоагулянта и антител к кардиолипину для диагностики приобретенной тромбофилии, скрининг включает в себя тесты на фактор V Лейдена и протромбин генных мутаций G20210A. Они являются двумя наиболее распространенных наследственных причин венозной тромбоэмболии и тромбофилии наиболее связаны с неблагоприятными исходами беременности (25). Распространенность этих мутаций относительно высока среди тех, европейского происхождения (до 15%), но очень низко на азиатов, африканцев и коренных американцев (25). Измерение сопротивления активированного протеина С является более глобальным тест для обнаружения как унаследованных и приобретенных форм активированного протеина С сопротивление. Скрининг на метилен тетрагидрофолата редуктазы (MTHFR) мутации, сыворотка гомоцистеина и антитромбина III, протеин S, и недостатки протеина С может также заслуживают рассмотрения, основанные на прошлом и семейной истории болезни (26). С учетом имеющихся данных, не существует достаточно доказательств в пользу скрининга тромбофилии как часть первоначальной оценки САП. Кроме того, неизвестно, будет ли лечение улучшит исход беременности у этих женщин. Большинство ранних потерь беременности из-за анеуплоидии и, в идеале все женщины с RPL (и гибель плода), должны иметь полный workups, в том числе кариотип потерь, чтобы исключить другие причины, прежде чем приписывать потери тромбофилии. Тромбофилии убедительно связано с увеличением относительного риска смерти плода, но не с рецидивирующим первом триместре потери. Кроме того, лечение может помочь тем, кто с тромбофилией и смерть плода, но лечение не была испытана в женщин с привычным в первом триместре потери и тромбофилии. Предварительные данные показывают, что комбинированное лечение аспирином и гепарином может улучшить исходы беременности у женщин с RPL и тромбофилии, но перспективных, контролируемых исследований не требуется. Экологические и другие объединенияКурение повышает риск самопроизвольного аборта и не следует поощрять. Потребление алкоголя более двух напитков в день, и высокий уровень потребления кофеина (более 300 мг / день) может повысить риск невынашивания беременности и лучше избегать. Экологические токсины, такие как тяжелые металлы (ртуть, свинец), органических растворителей (например, perchlorethlene или химчистка растворителя), ионизирующего излучения, а анестетик газов были причастны как возбудители для спонтанных абортов (27). Воздействие видеотерминалами, электрические одеяла, или подогревом водяные не связано с повышенным риском САП. Упражнение программы не увеличивают риск, и постельный режим не уменьшится риск САП.
Abbreviations: SHG -- sonohysterography; HSG -- hysterosalpingography; MTHFR -- methylene tetrahydrofolate reductase; TSH -- thyroid stimulating hormone; ПоследующийПосле полной оценки и успешного лечения, пары, которые испытали спонтанный аборт, часто боятся забеременеть снова. Эти пациенты нуждаются в интенсивной поддержке врач во время первого триместра беременности. Это полезно для информирования пары, что риск самопроизвольного аборта уменьшается продолжительность беременности увеличивается: наблюдение плодного яйца (12%), желточного мешка (8%), эмбриональные краун-крупа увеличивается длина (> 5 мм, 7%; 6-10 мм, 3%;> 10 мм, <1%). Наблюдение эмбрионального сердечной деятельности по беременности 6 недель снижает риск спонтанных абортов до 3% - 5%. Тем не менее, распространенность последующей спонтанных абортов выше, когда Есть и другие ненормальные сонографическое выводы: медленно или поздно появляются сердечной деятельности, размера и / или дата расхождения, или субхорионической гематомы. Наконец, прогностическое значение эмбриональных деятельность сердца уменьшается с увеличением возраста матери от спонтанных абортов составляет менее 5% женщин в возрасте от 35 до 29% у женщин в возрасте 40 лет и старше. РезюмеСамопроизвольный аборт является наиболее частым осложнением беременности. 40% до 50% оплодотворенные теряется до предполагаемого менструации, и на 30% до 35% теряется при или после пропущенных месячных. Традиционно периодические прерывания беременности (RPL) относится к потере подряд три или более беременностей, однако, многие врачи начнут оценки RPL после двух поражений, так как риск третьего потери после двух выкидышей составляет около 30%, тогда как риск после трех потерь составляет около 33%. Этот подход может быть особенно полезным у пожилых женщин. Риск выкидыша ниже у женщин, которые несут по крайней мере одну беременность, в то время как история выкидыша увеличивается вероятность выкидыша при последующих беременностях. Возраст матери также сильным предиктором рецидивирующих потерь. Основными причинами являются хромосомные RPL, анатомические / матки, эндокринные, иммунологические и тромбофилии. Оценка пара с RPL должна включать в себя следующее: родительские кариотипов; матки оценки с sonohysterography (ГВГ), HSG, и / или гистероскопия; оценка противопехотных мин: волчаночный антикоагулянт, антитела к кардиолипину, антитела к β2-гликопротеин-I; для проработки унаследовали тромбофилии, если потери произошли после 10 недель, и уровень сывороточного пролактина. Проработка RPL отрицательное в более чем 50% пациентов. Тем не менее, успешная беременность наступает у 35% до 80% пар, которые были оценены по RPL, независимо от этиологии и лечения. Важно помнить, что пары, которые в настоящее время анализируются для RPL имеют высокий уровень депрессии и стресса. Некоторые исследования показали, что психологическая поддержка может снизить темпы необъяснимые ошибки. Наконец, пациенты должны быть уверены, что даже без лечения, успешная беременность наступает в большинстве случаев. Ссылки
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||