Наследственные оценки риска рака в гинекологииWHEC практики Бюллетень и клинических управления Руководство для медицинских работников. Образования гранта, предоставленного здоровья женщин-образовательный центр (WHEC). Наследственные оценки риска рака должно быть частью рутинного акушерства и гинекологии практике. За последние десять лет произошло повышение осведомленности о наследственной предрасположенности к широкому спектру заболеваний, включая рак, болезни сердца и диабет. Все это сложные множества генов расстройств, но выявление конкретных генов, связанных с предрасположенностью к этим условиям позволила врачам более точно оценить риск и назначить профилактические мероприятия. Хотя это могут быть незнакомы многие практикующие, процесс стратификации риска рака может быть эффективным и действенным. Использование протокола управляемой оценки предрасположенности к раку, личных и семейных факторов риска и генетическое тестирование, можно создать рисков и стратегии управления, которые демонстрируют доказано снижение заболеваемости и смертности от рака. За десятилетия до генетического тестирования вошли практики, врачам было бы непосильным бременем для рака молочной железы и рака яичников, часто показывая ранним началом случаев и рак груди у мужчин. В середине 1990-х годов анализ сцепления в этих рака груди и яичников семей позволила выявить BRCA1 и BRCA2 , гены, которые обычно функционируют в репарации ДНК. Рак генетические консультанты использовать родословной анализа и клинических показателей для оценки вероятности того, что пациент несет наследственные мутации, чтобы определить, присвоено стратегии тестирования среди более сложных массивов коммерчески доступных анализов и интерпретации результатов и направлять медицинские рекомендации. Научных открытий, широкое информирование общественности и общей доступности клинического генетического тестирования BRCA1 и BRCA2 генов, ответственных за большинство семейной молочной железы и яичников, привели женщин представить кабинеты врачей с просьбой генетического тестирования и анкетирования клиническое значение для них и их семей. Цель этого документа для рассмотрения текущих рекомендаций для генетического тестирования на восприимчивость к рака, включая рак яичников, фаллопиевых труб, молочной железы, эндометрия и рака толстой кишки из-за унаследованных мутаций в BRCA генах или в репарации генов, связанных с наследственным раком толстой кишки неполипозный (HNPCC) синдрома. Семейный анамнез остается краеугольным камнем идентификации пациента. Этнической и расовой принадлежностью обычно оценивается как часть оценки. Практические применения генетического тестирования подверженности рака имеют возможность уменьшить бремя наследственных раковых заболеваний путем спасения жизни людей, снижение заболеваемости медицинских, а также снижение психологического стресса. Управление носителей мутации, в том числе показаниями для снижения риска операции, скрининг рака, и последующие, также рассматриваются. В обзоре также фокусируется на клиническую практику и практическое использование клинической генетики рака. ФонЕсть множество синдромов, которые придают и унаследованный риск рака молочной железы, яичников и раковых заболеваний, связанных с 5% до 15% всех рака груди и яичников вызвано одной из этих аутосомно, доминантно наследуемой рак синдромы (1),(2). Гены, связанные с наследственными синдромами рака всех передаваемых в менделевскую аутосомно-доминантный моды, так что материнский и отцовский семейных историй вносят равный вклад в риск пациента и должны быть оценены, чтобы определить целесообразность тестирования. Следует отметить, однако, что, хотя генные мутации передаются по наследству по аутосомно-доминантному типу, они выражаются в рецессивным путем (2). Человек, который наследует зародышевой мутацией, которая инактивирует одной копией гена в целом имеет второй функционально нетронутым копию гена. Только тогда, когда эта оставшаяся копия становится нормальным мутировал, что клетка может пройти процесс злокачественной трансформации. Роль акушеров и гинекологов включает:
Стратификации риска: Риск спорадические, семейного риска, риска и наследственныеБолее 10% больных имеют личные или семейные истории, предлагая здоровья или семейным наследственным раком восприимчивости и более чем на 6% пациентов отвечают национальным Comprehensive Cancer сети (NCCN) критерии для генетического тестирования (3). Три профилей риска появились:
Наследственный риск несет в себе высокий процент рака восприимчивости, в то время как спорадические риск несет в себе низкий. При стратификации риска, мы можем выявить лиц, которые могут получить выгоду от интенсивного скрининга, генетическое тестирование, и такие мероприятия, как химиопрофилактики и хирургическое сокращение риска. Генетическое тестирование соответствующих лиц дальнейшем позволяет выявить пациентов с наследственными синдромами рак, в своих собственных интересах, а также, что их всей семьей. После того, как семейный анамнез рака идентифицирован, моделей, рассмотренных ниже, используются для прогнозирования конкретного рака и вероятность генетической мутацией, которая предрасполагает пациента к развитию наследственного синдрома рака. Информированное согласие, в том числе риски, преимущества, параметры и ожиданиям, должны быть надлежащим образом обсуждается. Прямые советы необходимо в случае ненормальных семейные или личные истории рака. Номера для прямого консультирования снижает возможность пациента на усиление наблюдения и потенциальных ранней диагностики и профилактики рака, и ставит врача в опасности для будущего обязательства. Наследственные рака груди и яичников (HBOC) синдромНаследственные рака груди и яичников (HBOC) синдром является наследственным раком восприимчивости синдрома. Отличительными чертами этого синдрома несколько членов семьи с раком молочной железы или раком яичников или обоих, наличие как рак молочной железы и рака яичников у одного человека и ранний возраст наступления рака груди. В середине 1990-х годов было показано, что унаследовал мутации в BRCA1 и BRCA2 гена, на хромосомах 17 и 13 соответственно, были ответственны за большинство семейного рака груди и яичников. И женщины, и мужчины могут носить мутанта BRCA гена и передают его своим потомкам. «Красных флажков» для HBOC синдром - Личные и три поколения семьи, включая историю (4):
BRCA1 и BRCA2Приблизительно 10% случаев рака яичников и 3-5% случаев рака молочной железы из-за мутации зародышевой линии в BRCA1 и BRCA2 (1),(5). BRCA1 находится на хромосоме 17, и BRCA2 находится на хромосоме 13. Более 1200 различных мутаций были зарегистрированы для BRCA1 , и более чем 1300 различных мутаций были зарегистрированы для BRCA2 . BRCA1 и BRCA2 являются гены-супрессоры опухолей, которые кодируют белки, которые функционируют в процессе репарации ДНК (6) . Хотя люди с синдромом HBOC наследуют одну дефектную аллель BRCA1 и BRCA2 от своего отца или мать, у них есть второй, функциональный аллель. Если второй аллель становится нефункциональным, рак может развиваться путем накопления дополнительных мутаций. Это называется "два хита гипотеза» (7) . В общей популяции, по оценкам, примерно 1 на 300 до 1 на 800 человек несут мутацию в генах BRCA1 и BRCA2 (8) . Население евреев ашкенази представляет собой заметное исключение, потому что есть три конкретных мутаций учредителя (BRCA1 кодон 185deletion AG, BRCA1 кодона 5374 вставки С и BRCA2 кодона 6174 удаления T), которые проводятся примерно на 2,5% людей (8) . В связи с этим, большинство экспертов имеют гораздо более низкий порог для генетического тестирования в еврейских женщин. Для женщины с BRCA1 мутации, риск развития рака яичников является 39-46%. Для женщины с BRCA2 мутации, риск развития рака яичников является 12-20%. Предполагаемый риск продолжительности жизни рака молочной железы BRCA1 или BRCA2 мутации 65-70% (9) . Для женщин с раком молочной железы, 10-летняя выживаемость без риска развития рака яичников последующие составляет 12,7% для BRCA1 носителей мутации и 6,8% для BRCA2 носителей мутации (10). Рак яичников связан с BRCA1 и BRCA2 мутации имеет ярко выраженный гистологический фенотип. Этот вид рака является преимущественно серозного или эндометриоидные гистологии и высокий класс. Коллоидный рак яичников и пограничное не кажутся часть опухоли спектра (11). Первичный рак фаллопиевых труб и первичный перитонеальный рак также являются спектра заболеваний, связанных с BRCA1 и BRCA2 мутации (12). Критерии оценки риска генетическихПациенты с более чем приблизительная 20-25% вероятность наличия наследственной предрасположенности к раку молочной железы и рака яичников и для кого генетической оценки риска рекомендуется (13):
* Рака брюшины и фаллопиевы трубы должны рассматриваться как часть спектра HBOC синдрома. †Близкий родственник определяется как первой степени родства (мать, сестра, дочь) или второй степени родства (бабушка, внучка, тетя, племянница). Пациенты с более чем приблизительные 5-10% вероятность наличия наследственной предрасположенности к раку молочной железы и рака яичников и для кого генетическая оценка риска может быть полезным (13):
HBOC риска синдрома Заброшенные инструментМы разработали простой числовой средство обучения, которые могут быть использованы для оценки кандидатуры пациента для BRCA тестирования. Этот инструмент приближается NCCN руководящие принципы, назначив 1 или 2 пункта до каждого человека с каждым "Красное знамя" соответствующие рака в три поколения семьи дерева. Точки пациента добавляются вместе с материнской точки, а затем снова с отцовской очков. Сумма 0 точка будет указывать на спорадические (низкий) классификации. Сумма 1 пункт, как правило, указывают на семейные (средний) классификации рисков, однако, по 1 точке пациент может иметь право на генетическое тестирование, если есть ограниченный структуре семьи или этнической предрасположенности к BRCA мутаций. Сумма> 2 баллов, как правило претендовать на BRCA тестирования, хотя комбинации, которые включают третьей степени родственники могут быть оценены, чтобы определить, если тестирование является оправданным. Этот инструмент должен быть использован только в качестве оценки, а не окончательное руководство тестирования. Обведите каждого элемента, который применяется, то сумма А + В и А + С
Каждый первичный рак подсчитываются отдельно
HBOC, hereditary breast and ovarian cancer; LFS, Li-Fraumeni syndrome 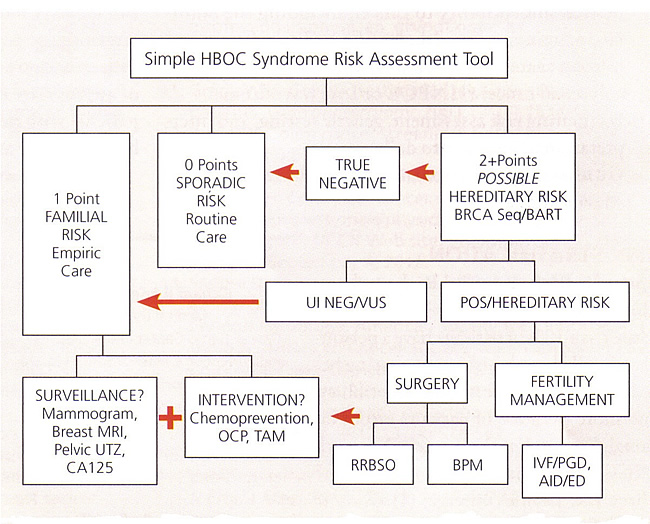 Abbreviations: AID, artificial insemination by donor; BART, BRCA Analysis rearrangement test; BPM, bilateral prophylactic mastectomy; CA 125, cancer antigen 125; ED, egg donation; HBOC, hereditary breast and ovarian cancer; IVF, in-vitro fertilization; MRI, magnetic resonance imaging; OCP, oral contraceptive pills; PGD, preimplantation genetic diagnosis; POS, positive; RRBSO, risk-reducing bilateral salpingo-oophorectomy; TAM, tamoxifen; UI NEG, uninformative negative; UTZ, ultrasound; VUS, variant of uncertain significance. Генетическое консультирование для снижения риска рака молочной железыГенетическое консультирование должно включать обсуждение возможных результатов тестирования - в частности решения вопросов положительных, отрицательных и неинформативные результаты испытаний, или варианты неизвестного значения. Опции для наблюдения, химиопрофилактики и снижения риска операции должны быть обсуждены перед испытанием. Возможные психологические и семейные последствия результатов испытаний также должны быть рассмотрены. Письменные материалы могут помочь людям обмениваться информацией с родственниками о своих потенциальных генетических рисков. Генетической консультации должны также включать обсуждение стоимость генетического тестирования. Многие страховые компании, в том числе медицинской, покроет значительную часть расходов для определенных лиц. Medicare и другие страховые компании письменные инструкции для покрытия расходов на генетическое тестирование. Важный аспект генетического консультирования является обсуждение действующего законодательства в отношении генетической дискриминации и конфиденциальности генетической информации. Федеральный закон Генетическая информация недискриминации 2008 года защищает людей от здравоохранения и занятости дискриминация по генетической информации. Многие государства также имеют государственные законы, которые предоставляют аналогичную защиту. Эти законы не распространяются на другие виды страхования, которые могут включать в себя жизни или страхование на случай инвалидности. В идеале, это имеет смысл приступить к проверке в пострадавших человек. Если, однако, нет пострадавших человек не доступен, генетическое тестирование еще может дать полезную информацию. Если вредные мутации идентифицированы, пациентов с риском может быть соответствующим образом проинформированы относительно скрининга или других подходов по уменьшению риска. Если никаких вредных мутаций не определена, пациенты должны быть проинформированы, что это может быть потому, что одной из нескольких возможностей, включая (а) вредное настоящее мутация в семье, что пациент не унаследовали, (б) обнаружить мутации в BRCA1 и BRCA2 , или еще не идентифицированного гена восприимчивости рак присутствует в семье, и остается неизвестным, является ли пациент доля эта предрасположенность, или (с) не наследственная предрасположенность в семье. В настоящее время стратегии, чтобы снизить риск развития рака яичников и рака фаллопиевых труб у женщин с высоким риском с известными вредными BRCA мутаций включают наблюдение, химиопрофилактики и хирургии. Учитывая крайне высокий риск развития рака яичников и фаллопиевых труб рака у женщин с мутациями в генах BRCA1 и BRCA2 , консенсус группы рекомендуется периодическое скрининг с СА 125 и трансвагинальное УЗИ, начиная в возрасте от 30 лет и 35 лет и 5-10 лет назад чем самый ранний возраст первого диагноза рака яичников в семье (14). Низкая распространенность рака яичников и высокую вероятность положительного результата теста скрининга необходимым дальнейшее инвазивные хирургические оценки препятствий при раке яичников программы скрининга среди женщин в унаследовал риска (15). Остается надеяться, что будущие суда раком яичников выиграют от лучшего сывороточных маркеров и улучшенные алгоритмы скрининга для повышения способности различать между нормальным и ненормальным CA 125 ценности и ультразвукового исследования. Преимущества и величины с уменьшенным риском оральных контрацептивов для женщин с BRCA мутации не сообщалось, как последовательно, как для общего, низкого риска. Целесообразно для женщин с мутациями в генах BRCA1 и BRCA2 , использовать оральные контрацептивы. Большинство исследований свидетельствуют о снижение риска развития рака яичников среди тех, использующих оральные контрацептивы на более длительный срок (более 3 до 6 лет) (16). Относительные риски и преимущества для обоих химиопрофилактики и репродуктивного контроля должны быть тщательно взвешены пациентом, и ее врач. Профилактические Двустороннее удаление придатков матки (БСО)Настоятельно рекомендуется у женщин, которые несут BRCA мутаций из-за высокой смертности рака яичников и отсутствие эффективного скрининга и профилактики подходы (17). К счастью, риск наследственного рака груди и яичников не поднимается резко до конца 30-х годов у женщин с BRCA1 мутации, и в конце 50-х годов для женщин с BRCA2 мутации (18), так что женщины имеют возможность завершить их семей перед прохождением БСО. Прошлая практика проведения профилактических хирургии основан исключительно на истории семьи в значительной степени должны быть оставлены. Половина женщин в семьях с BRCA мутаций не было бы ожидать, чтобы быть носителями. В настоящее время решение о проведении профилактических хирургии БСО основывается главным образом на результатах BRCA мутационный анализ. Существует ряд доказательств, что определенные типы BRCA мутации предрасполагают сильнее с раком яичников, но это наблюдение не было подтверждено последовательно (19). Хотя БСО является основной хирургической процедуры, исследования показывают, что большинство женщин с высоким риском проходят генетическое тестирование принимать профилактические двусторонние удаление придатков матки. Лапароскопии и лапаротомии оба варианта снижения риска БСО. Для обеих процедур, тщательный осмотр поверхности брюшины необходимо. Перитонеальный промывки должна быть получена. Диафрагма, печень, сальник, кишечник, paracolic желоба, и приложение проверяется в животе. Яичников, маточных труб, матки, мочевого пузыря серозной и куль-де-мешок проверить в тазу. Любые патологические участки должны пройти биопсию. Яичников сосуды должны быть выделен и лигирован проксимального конца идентифицируемых ткани яичников гарантировать, что все ткани яичников полностью удаляется. Если гистерэктомии не выполняется, маточные трубы должна быть разделена на ее введение в матку Корню. При выполнении лапароскопической процедуры, оптимизировать сохранение поверхностного эпителия яичников, образцы могут быть помещены в эндоскопической мешок перед удалением из брюшной полости. Решение о проведении одновременных гистерэктомии должно быть индивидуальным. Аргументы в пользу гистерэктомии включают более упрощенной стратегии гормональной терапии (с эстрогеном только) и теоретические повышенный риск развития рака роговицы в маточной трубе (20). Кроме того, гистерэктомии можно считать, когда есть другие медицинские показания для удаления матки и шейки матки. Для женщин, принимавших тамоксифен, гистерэктомия может рассматриваться, чтобы уменьшить их риск рака эндометрия (21). Плюсы и минусы снижения риска удаление придатков матки
Минусы:
Какого возраста следует учитывать снижение риска удаление придатков матки?Снижению рисков и элективных придатков oophorectomies являются удаление яичников и маточных труб для потенциальной пользы предотвращение долгосрочных заболеваемости и смертности. Термин снижения риска удаление придатков матки означает, что яичники нормальных во время удаления. Женщины с BRCA1 или BRCA2 мутации должны быть предложены снижения риска удаление придатков матки по возрасту 40 лет, или когда детородного завершена (13). Рак яичников диагностируется в менее 2-3% женщин с BRCA1 или BRCA2 мутации в возрасте до 40 лет. Для женщин с BRCA1 мутации, риск развития рака яичников заметно увеличивается в течение 40 лет, с 10-21% от BRCA1 носителей мутации развития рака яичников в возрасте старше 50 лет. Риск рака яичников пременопаузе намного ниже в BRCA2 носителей мутации, с не более чем на 3% BRCA2 носителей мутации развития рака яичников в возрасте старше 50 лет (13),(22). Учитывая различные сроки риск развития рака яичников, рассмотрение может быть сделано для консультирования пациентов с BRCA1 мутаций иначе, чем для BRCA2 носителей мутации. Тем не менее, женщины с BRCA2 мутации имеют 26-34% вероятность развития рака молочной железы в возрасте старше 50 лет (18),(22), и с максимальной выгодой удаление яичников на уменьшение груди риском рака достигается ранее яичники удалены (23). Учитывая эти проблемы, сроки снижения риска удаление придатков матки должна быть основана на индивидуальных потребностях пациента, принимая во внимание их желание сохранить фертильность или предотвратить преждевременное хирургической менопаузе с возрастной воздействие снижения риска удаление придатков матки с обеих груди рака и риска гинекологического рака. Профилактические сальпингэктомия и задержанный OophorectomyПрофилактические двусторонние удаление придатков матки рекомендуется для женщин с BRCA мутаций, но есть и негативные последствия преждевременной менопаузой. Большинство BRCA -связанного рака яичников видимому, возникают в маточной трубе, поэтому сальпингэктомией может быть альтернативой двусторонние удаление придатков матки. С пониманием того, что, возможно, 60% тазовой серозный рак может происходить в маточной трубе, была более поздней обсуждение снижения риска сальпингэктомия качестве потенциального альтернативой снижения риска BSO для лечения BRCA носителей мутации, особенно у женщин хотят проходить снижения риска БСО (39) . Авторы публикуют свои Маркова Монте-Карло сравнения снижению риска БСО в возрасте 40 лет и с риском снижения сальпингэктомией на 40 лет последующей задержкой двустороннего удаления яичников на 50 лет (40). Это вдумчивый модель предсказывает ожидаемое сокращение тазовой серозного рака, рака молочной железы, а также дополнительных случаев смерти от сердечно-сосудистых заболеваний. Вывод исследования было двустороннее удаление придатков матки часто наибольшее снижение риска рака груди и яичников у носителей BRCA мутации. Тем не менее, при рассмотрении с поправкой на качество жизни, двусторонние сальпингэктомией с задержкой удаления яичников является экономически эффективной стратегии и может быть приемлемой альтернативой для тех, кто желает пройти двусторонние удаление придатков матки (40). Важно подчеркнуть, что стандарт лечения для женщин зародышевой линии наследования мутаций в генах BRCA1 и BRCA2 остается профилактическая БСО после завершения детородного или в возрасте около 40 лет. Он предлагает наибольшее снижение риска рака груди и яичников по сравнению с сальпингэктомией с задержкой или без удаления яичников. Тем не менее, значительная доля женщин, не подвергаются БСО, и многие выбирают для наблюдения только рака яичников, несмотря на ограниченную пользу существующих методов скрининга (41). Рак яичников приводит смертность среди BRCA носителей мутации, поэтому любое вмешательство, которое снижает риск рака яичников, скорее всего, быть подтверждено перспективно, двусторонние сальпингэктомией с задержкой удаления яичников может быть разумной альтернативой БСО, особенно для тех, которые не хотят, чтобы пройти последний Процедура из-за потенциального влияния на качество жизни. Управление Женщины с отягощенным семейным анамнезом и отрицательные BRCA1 или BRCA2 мутацииХотя, в большинстве случаев, наследственная предрасположенность к раку яичников вызывается мутациями в генах BRCA1 или BRCA2 , современная технология не позволяет идентифицировать все мутации, которые должны существовать в этих генах (24). Кроме того, связь исследования показали, что меньше половины семей с четырьмя и более случаев рака молочной железы, но ни одного случая рака яичников (семьи с конкретным участкам рак молочной железы), рак молочной железы не вызваны BRCA1 или BRCA2 мутации (25). Учитывая эти проблемы, женщины с личной или семейной историей рака молочной железы, которые дали отрицательный результат на BRCA мутаций должно осуществляться на основе их семейной истории. Предварительные данные показали, что женщины из семей с историей конкретных участков рака молочной железы, в которых не BRCA мутации не идентифицировано остаются на значительно увеличенный риск рака молочной железы, но не может быть на значительно повышенный риск развития рака яичников (26). Это важно для лиц с высоким риском, чтобы оставаться на связи с врачей, имеющих опыт в уходе за женщин с повышенным риском, в связи с быстро развивающимися исследований и уточнений в тестировании технологии. Например, тест на больших перестановок в BRCA1 и BRCA2 гена была разработана, которые могут помочь в выявлении мутации в небольшом проценте семьях высокого риска, которые ранее дали отрицательный результат на этих генов. Репродуктивные параметрыРезультаты генетического тестирования может иметь глубокое влияние на решения, планирования семьи для лиц репродуктивного возраста, оказываются носителями BRCA1/2 мутациями. Например, в тех случаях, когда оба партнера несут BRCA2 мутации, может быть высокий риск для потомства развивать редкий анемия Фанкони / опухоль головного мозга фенотип (рецессивные расстройства). Консультации для репродуктивного варианты, такие как пренатальная диагностика, предимплантационной генетической диагностики (ПГД) и вспомогательная репродукция, следовательно, может быть оправдано для пар, выразив озабоченность по поводу BRCA носителем мутации статуса их будущего потомства. Такое консультирование должно включать всестороннее обсуждение потенциальных рисков, преимущества и ограничения репродуктивных возможностей. Пренатальная диагностика включает в себя после имплантации генетического анализа ранних эмбрионов, используя ворсинок хориона или образцов амниотической жидкости клеток; генетическое тестирование обычно проводится между 12-й неделе и 16 неделе беременности, и результаты тестирования потенциально способны привести к решению пары, чтобы прервать беременность (27). В течение последних двух десятилетий, ПГД появился как альтернативный метод генетического тестирования у ранних эмбрионов. PGD включает тестирование 1 или 2 клетки из эмбрионов на очень ранних стадиях развития (то есть, от 6 до 8 клеток) после экстракорпорального оплодотворения (ЭКО). Эта процедура позволяет по выбору не влияет эмбрионы в матку, и может, таким образом, имеют то преимущество, избегая потенциальной прерывания беременности. Тем не менее, процедуры, такие как ПГД не без ограничений, как это может по-прежнему требуют подтверждающего пренатальной диагностики в зависимости от медицинских потребностей супругов или по запросу. Кроме того, процесс PGD требует использования IVF независимо от фертильности статус пары (т.е. также относится к пар без проблемы бесплодия) и IVF не всегда может привести к успешной беременности. Наконец, технологии или экспертизы не могут быть легко доступны в географическое расположение пары. Различные факторы, как медицинских, так и личные, должны быть взвешены в решении использовать пренатальной диагностики или ПГД. Медицинские соображения могут включать такие факторы, как возраст начала наследственных заболеваемости раком, пенетрантность, тяжести или связанные с ними и смертность от рака, и наличие эффективных риск рака методы снижения или эффективного лечения. Хотя использование пренатальной диагностики или ПГД относительно хорошо установленным для тяжелых наследственных заболеваний с очень высокой пенетрантностью, их использование в условиях, связанных с более низкой пенетрантностью (например, груди или наследственная синдром рака яичников) остается несколько спорным как с этической и нормативной точки зрения. Личных соображений для решения использовать пренатальной диагностики или ПГД могут включать личные этические убеждения, системы ценностей, культурных и религиозных убеждений, а также социальных и экономических факторов. Исходя из результатов исследования вводят женщин с высоким риском развития наследственных груди или рака яичников, 50% -75% респондентов считают, что ПГД была приемлемым вариантом для высокого риска отдельных но только около 14% -33% будет рассматривать себя переживает PGD (28). Важно отметить, что исследования предположили, что большинство женщин с высоким риском имеют мало или не знают ПГД, подчеркнув необходимость более эффективного информирования и просвещения в отношении возможных вариантов репродуктивного. Успешные роды были зарегистрированы с использованием ПГД и ЭКО в BRCA1/2 носителей мутации, но данные в опубликованной литературе по-прежнему очень ограничены. Кроме того, данные, относящиеся к долгосрочной безопасности или результатов PDG и вспомогательной репродукции в BRCA носителей мутации еще не доступны. Наследственный неполипозный Рак толстой кишки (HNPCC) или синдром ЛинчаЭто аутосомно-доминантное наследственное заболевание системы репарации ДНК несоответствие. Многие власти ссылаются на HNPCC как синдром Линча, полагая, что HNPCC не позволяет адекватно признать важность extracolonic злокачественных новообразований, таких как рак эндометрия, яичников, верхних отделов пищеварительного тракта и мочевого-кишечного тракта, связанные с этим заболеванием. Этот синдром приходится 5-10% всех толстой кишки и рака эндометрия (29). Анализ сцепления с высокой степенью риска семей привели к открытию, что Линч синдром вызывается зародышевой линии мутации в класс генов, ответственных за ремонт определенных типов мутаций ДНК (29). Эти гены называются "репарации" гены и приводят к белкам, корректировать ДНК и исправлять ошибки, которые сделаны во время нормального процесса репликации. MSH2 (MutS гомолога 2) и MLH1 (L MutL гомолог 1) являются наиболее часто мутировал несоответствие генов репарации при этом синдроме. MSH2 и MLH1 расположены на хромосомах 2P16 и 3p21 соответственно. Зародышевой линии мутации в других генах репарации ошибочного спаривания ( MSH6 , PMS1 и PMS2 ) были определены, но на более низкой частоте (29). Вероятность развития рака, если есть зародышевой линии MLH1 или MSH2 Мутация:
Семейный анамнез является первым шагом в определении того, пациент с повышенным риском наследственным заболеванием. Несколько относительно строгие критерии были разработаны с целью выявления лиц с высоким риском развития синдрома Линча. Около 30% семей Bethesda выполнения критериев и 50-92% семей выполнения критериев Амстердаме будет зародышевой линии репарации ДНК мутации гена (30),(31). Bethesda HNPCC критериев (см. ниже), как представляется, наиболее чувствительным в предсказании мутации репарации в HNPCC семей (30). Любое из следующих:
Амстердам II критериям (см. ниже) для ННКР являются более конкретными (31). Все приведенные ниже:
HNPCC / синдром Линча Простой инструмент оценки рисков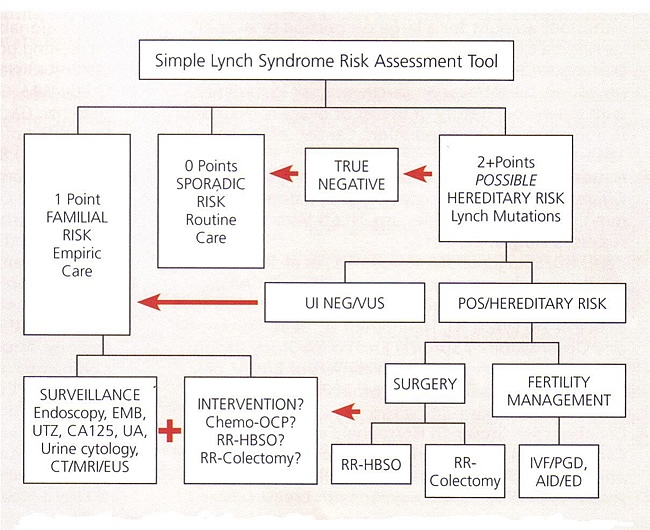 Abbreviations: AID, artificial insemination by donor; CA 125, cancer antigen 125; CT, computed tomography, ED, egg donation; EMB, endometrial biopsy; EUS, endoscopic ultrasound; HBSO, hysterectomy with bilateral salpingo-oophorectomy; IVF, in-vitro fertilization; MRI, magnetic resonance imaging; OCP, oral contraceptive pills; PGD, preimplantation genetic diagnosis; POS, positive; RR, risk-reducing; UA, urinalysis; UI NEG, uninformative negative; UTZ, ultrasound; VUS, variant of uncertain significance. Надзор за наследственный рак толстой кишки неполипозный (HNPCC)Когда мутации идентифицированы, более простой, менее дорогостоящие, генетический анализ может быть выполнена на других членов семьи. Обширные консультации рекомендуется до и после испытаний. Как только генетический процесс был завершен, риск рака может быть назначен для пациента и ее семьи. Когда мутация была идентифицирована, генетическое тестирование должно быть доступным для всех членов семьи. Эти лица должны пройти каждый генетическое консультирование так что преимущества и недостатки тестирования может быть объяснено. Носители мутации предлагаются интенсивным наблюдением. Если мутация не отождествляется у пациента, но семья отвечает критериям Амстердам протокол синдром Линча, наблюдение должно наблюдаться. Смертность от колоректального рака в этой группе было показано, должен быть сокращен на колоноскопию скрининга (32). Большинство специалистов считают, что снижение риска гистерэктомии с двусторонней удаление придатков матки играет важную роль в управлении этими пациентами. Колоректального рака в HNPCC синдромом имеют тенденцию принимать в проксимальных толстой кишки, по сравнению с отдельными случаями, которые чаще всего дистальных. Профилактические колэктомией рекомендуется пациентам с HNPCC мутация в которых полипы выявляются в молодом возрасте, а также пациентам, у которых полипы, которые являются нестабильность микросателлитных-положительные или тех лиц, которые не в состоянии пройти регулярное наблюдение. Химиопрофилактики использованием нестероидных противовоспалительных агентов в этой группе больных, чтобы предотвратить полипы толстой кишки в настоящее время рассматривается, и данные должны быть оказана. Если эти пациенты в настоящее время изучаются и по другой причине, следует рассмотреть на консультации относительно возможных рисков и преимуществ тотальной гистерэктомии с двусторонней удаление придатков матки.
GI, gastrointestinal Li-ФраумениСиндром Ли-Фраумени (ОРС) связан с зародышевой линии мутации в ген-супрессор опухоли TP53 , которые вызывают чрезвычайно проникающих предрасположенность к развитию саркомы, а также ранним началом молочной железы, мозга, коры и других видов рака. Люди с LFS иметь абсолютный риск развития любого рака около 50% в возрасте 30 лет и 90% в возрасте 60 лет (34). LFS составляют до 1% от рака молочной железы в Соединенных Штатах; таких злокачественных опухолей может иметь отличительные фенотип, выражая гормональных рецепторов и HER2/neu. Мутация De Novo частота оценивается в 7% до 20%, так что TP53 тестирования могут быть неподходящими для отдельных пациентов при отсутствии семейной истории рака (34). Синдром CowdenCowden синдрома (КС) передает повышенная восприимчивость к груди, щитовидной железы, эндометрия и рака толстой кишки, и доброкачественных гамартомы, поражающее многие органы. Это аутосомно-доминантное заболевание, связанное с мутациями в гене подавителя опухоли PTEN. Гинекологические злокачественных новообразований являются общими с 5-10% риск рака эндометрия и 25-50% риск рака молочной железы (42). Внешние проявления включают макроцефалией и папилломатозной папулы на лице, устных языках слизистую оболочку, и конечностей, которые почти повсеместно по возрасту 30 лет. Рак груди жизни риск составляет 25-50%, при этом средний возраст диагностики 38-46 лет (35). Время жизни риск развития рака эндометрия составляет 5-10% (35). Половые мутации PTEN гена выявлены примерно 80% больных, соответствующих клинико-диагностических критериев, почти половина из которых не имеют семейной истории CS. Сообщил CS частота составляет 1 к 200 000, но это, скорее всего, не диагностируется (35). Периодические, множественные полипы эндометрия предвещать высокий риск развития рака эндометрия у женщин с CS. Мониторинг злокачественности и рассмотрение гистерэктомии после завершения детородного является оправданным (42). Наследственный синдром диффузного рака желудкаНаследственный синдром диффузного рака желудка связан с мутациями в CDH1 гена и характеризуется 80% жизни риск развития рака желудка (36). Женщины с CDH1 мутации имеют до 60% жизни риск развития рака молочной железы лобулярного, однако распространенность CDH1 мутаций в женщин, отобранных для раннего возраста начала заболевания или семейной историей рака молочной железы лобулярного низкая, около 1% (36). Среди семей с диффузным желудка и лобулярного рака молочной железы, CDH1 мутаций, выявленных в 25-50% (36). Peutz-ЕгерсаPeutz-Егерса (ПАО), в результате изменений в STK11 генов, особенности Hamartomatous полипов в желудочно-кишечном тракте, что приводит к ее восприятию и непроходимость кишечника. STK11 1 мутации передают повышенный риск рака молочной железы, яичников, шейки матки, поджелудочной железы, желудка и толстой кишки рак, в дополнение к доброкачественные опухоли шнур пола. Риск рака молочной железы достигает 8% в возрасте 40 лет и 32% в возрасте 60 лет. Половина STK11 носителей мутации имеют семейную историю ПАО (37). Нейрофиброматоз-1Нейрофиброматоз-1 (NF-1) Характеристика кожного нейрофибромами и злокачественных опухолей оболочки периферийных нервов, неспособность к обучению, и распространенность 1 в 3000 живорожденных (38). Недавнее исследование женщин с NF-1 сообщил о пяти-кратное увеличение риска развития рака молочной железы в возрасте до 50 лет и от 3 - до 4-кратным увеличением риска рака в течение жизни (38). Улучшение Стандартный онкологической помощиКак скрининга наследственных раков стали более доступными, многие вопросы, касающиеся ответственности, управления рисками и безопасности пациентов появились. Как и во всех медико-правовых вопросов, эти проблемные области в целом относятся к стандарту внимательности, документация, согласия, ожидания пациента, и последующей деятельности. Многие провайдеры считают, что наследственная скрининга рака не стандарт медицинской помощи в первичном офисе помощи. Тем не менее, есть три точки, которые очень важны, чтобы помнить. Это стандарт медицинской помощи, чтобы получить всеобъемлющую и полную семейную историю и обновлять ее на регулярной основе. Это стандарт медицинской помощи, чтобы дать пациентам соответствующую информацию на основе этой семейной истории, чтобы они могли принимать компетентные решения относительно их медицинского обслуживания. Наконец, стандарт медицинской помощи, чтобы тщательно и полностью запись того, что было обсуждено с пациентом. Если вы будете придерживаться этих трех пунктов, то, казалось бы, что скрининг на наследственные рака, по сути, стандарт лечения. Документация: После того как вы определили, что кто-то подходит критерии для генетического тестирования, сколько документация необходима? Это адекватное иметь Ваши заметки состоянии: "Информация о генетическом тестировании дано" или "Брошюра дано?" хотя это приятно видеть ваш план документально, это гораздо важнее увидеть обоснование плана. В этом случае, расширенные отметить такие, как:. ", Основанный на истории семьи, генетическое тестирование рекомендуется пациент понимает, что если тест положительный есть существенное увеличение риска яичников и / или молочной железы или [конкретный синдром Линча рака Вы скрининг]. " Хотя мы знаем, что мы обсуждали риски рака, пациент может противоречить тому, что легко не документирована в их графике. Пациенты могут возразить, что если бы они понимали свои риски, они бы, конечно, дали согласие на тест. Включение какая-то система слежения в ваш офис разумно. Это может позволить для Вас, чтобы последующие с пациентом после того как она была передана для генетического консультирования. Без этого типа отслеживания и следить, тревожный вопрос может быть поднят: "Если вы чувствовали, что это достаточно важно для пациента, чтобы это тестирование, почему она не достаточно важно для вас, чтобы увидеть, если испытание было сделано" Информированное согласие: информированное согласие или отказ информированные должны быть рассмотрены при обсуждении наследственных оценки риска. Как правило, информированное согласие занималась только с информирования пациентов о рисках, связанных с инвазивными процедурами. Тем не менее, было расширение того, что достаточный информированное согласие включает. В рамках адекватного информированного согласия мы сейчас попросили дать все варианты лечения, а также риски и преимущества каждого из вариантов. Поэтому, если мы не даем соответствующие пациентам возможность генетического тестирования (вместе с его риски и выгоды), мы можем быть признаны небрежного на основе согласия в случае достижения неблагоприятных событий. Это где информированный отказ может вступить в игру, если пациент не хочет делать то, что поставщик чувствует себя не подходит, или не последовали генетические направления консультирования, когда вы направили ее к одному, документирование их отказа или отсутствия последующих -до, в конечном итоге может быть более важным, чем документирование их согласия. Обоснованного отказа документы, что врач сделал то, что разумно и что это выбор пациента, чтобы не идти до конца. У многих государств есть некоторый элемент небрежности, и это может пойти дальше и документально подтвердить причину отказа пациента; страх результат теста, нежелание что-либо сделать результат, или финансовым причинам может быть частью решения пациента отказаться от прохождения тестирования. В настоящее время одной из основных причин профессиональной небрежности включает в себя вопросы с раком молочной железы. Как правило, обвинения включают в себя как поздней диагностики и отказ диагностировать. Сейчас мы наблюдаем новый утверждение, что в настоящее время называют провал нашей "обязанность информировать» или «обязанность предупредить". Это относится и к связи с неустановлением пациента с риском для наследственного рака, так что усиление наблюдения могли бы быть реализованы, чтобы диагностировать рак раньше или, что снижение риска или профилактической операции могли быть выполнены. Подобных случаях будет очень трудно, если не невозможно, защищать без надлежащей документации, включая документацию об отказе пациента тестирование и документирование объяснение очень специфические риски рака. РезюмеБолее 300 000 женщин США, по оценкам, находятся под высоким унаследовал риск развития рака груди и яичников. Более широкий спектр генетических тестов доступны для определения риска пациента, но результаты все еще может оказаться безрезультатным или сложно интерпретировать. Генетики рака специалисты предлагают комплексную оценку рисков, консультирование и управление рекомендации для пациентов и семей с наследственной предрасположенностью для развития рака груди и яичников. Как специалисты в здоровье женщин, наследственную оценки рисков это наша ответственность. Сосредоточена история рака семья должна быть частью первоначальной оценки всех пациентов. Материнской и отцовской родословной должны быть построены, чтобы включить по крайней мере трех поколений (, пациента ее родителей, и ее бабушки и дедушки поколений). Информация о возрасте членов семьи на момент постановки диагноза и дополнительных деталей, таких как рак молочной железы в обеих грудях очень полезно. Обновление истории семьи должны спросить о на ежегодных экзаменах, потому что дополнения и новых диагнозов может изменить первоначальные рекомендации относительно генетического тестирования. Генетической оценки риска рекомендуется для пациентов с более чем приблизительная 20-25% вероятность наличия наследственной предрасположенности к раку молочной железы и рака яичников. Женщины с BRCA1 или BRCA2 мутации должны быть предложены по снижению риска удаление придатков матки по возрасту 40 лет или когда детородного завершена. Для снижения риска двусторонние удаление придатков матки, все ткани яичников и маточных труб должны быть удалены. Капитальный визуализации брюшную поверхность с тазовой промывки должны быть выполнены. Полная, серийные срезы яичников и маточных труб необходимо, с микроскопическим исследованием оккультного рака. Ссылки
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||