Cancer du sein: la détection précoce On estime que 217.640 nouveaux cas de cancer du sein seront diagnostiqués aux États-Unis cette année, plus de 99% de ces cancers du sein surviennent chez les femmes. Cancer du sein est le cancer le plus fréquent chez les femmes américaines et il est la deuxième cause de décès par cancer chez les femmes américaines (cancer du poumon est en premier). Risque à vie d'une femme (de 80 années d'existence) de développer un cancer du sein est de 12,5%, soit 1 pour 8. La détection précoce du cancer du sein a été montré une diminution de la mortalité. La technologie continue d'évoluer afin d'améliorer la précision de la détection. Le but de ce document est de discuter de la justification pour les lignes directrices actuelles de dépistage du cancer du sein et d'évaluer les éléments de preuve concernant les techniques de dépistage. Il se concentre aussi sur la mammographie et autres techniques de détection comme outils de dépistage pour identifier des lésions non palpables. Cette information est conçue pour aider les praticiens à prendre des décisions concernant les soins appropriés. Variations dans la pratique mai être justifiée en fonction des besoins de chaque patient, les ressources et les limitations propres à des institutions ou du type de pratiques. Facteurs de risque: L'épidémiologie analytique - Pourquoi les femmes acquièrent le cancer du sein est moins bien comprise. Plusieurs facteurs ont été identifiés à un risque accru, tels que: la maladie bénigne du sein, les facteurs génétiques, alimentation, hormones exogènes, l'alcool et la consommation de tabac, les traumatismes du sein et les virus. Risque de cancer du sein augmente en étant une femme et de plus en plus âgés; 70% des cancers surviennent dépassé l'âge de 50 ans. Antécédents familiaux de cancer du sein dans une primaire parent (mère, sur ou fille) augmente le risque. D'autres facteurs sont: l'apparition précoce des menstruations (période obtenir avant l'âge de 12 ans), ne donnant jamais la naissance ou la première grossesse a dépassé l'âge de 30 ans, pesant plus de 40% au-dessus du poids idéal et de l'exposition au DDT (pesticide), PCB, ou excessive rayonnement de la paroi thoracique. Plusieurs études ont démontré que les facteurs de risque les plus importants pathologique pour le développement ultérieur de cancer sont le degré et la nature (typique ou atypique) de la prolifération épithéliale. Diagnostic de pathologie mammaire regroupés par le risque de cancer (1):
Dépistage du cancer du sein Outils de dépistage ne sont efficaces que leur capacité d'aider à la prévention des maladies. La méthode de dépistage biologique idéal devrait identifier et de changements statistiquement significatifs associés au développement du cancer. Il devrait également être applicable à une proportion raisonnable de personnes à risque, et il devrait être minimalement invasive. En outre, une intervention efficace et des mesures préventives devraient être disponibles. La recherche de meilleures méthodes de prévention du cancer du sein et le dépistage se poursuit avec l'objectif de réduction de la mortalité de manière significative, comme cela s'est produit avec le cancer du col utérin. Obstétriciens et gynécologues sont dans une position favorable pour diagnostiquer les maladies du sein chez leurs patients. Première étape vers ce sera l'examen du sein, par inspection visuelle et la palpation et il devrait être partie intégrante de la formation initiale d'obstétrique et de tous les examens gynécologiques complets. Les patients doivent être instruits dans la technique de la vie, l'auto-examen périodique long de la poitrine et informés de l'importance de l'auto-examen. Auto-examen du sein (ESB): Malgré l'absence de données définitives pour ou contre l'auto-examen des seins (AES), l'auto-examen des seins a le potentiel pour détecter le cancer du sein palpable et devrait être recommandé. Le cancer du sein est le plus auto-découverte de tous les cancers. En fait, la plupart des cancers du sein aux États-Unis sont détectées par palpation. L'auto-examen des seins (AES) doit être faite dans une chambre confortable qui contient un lit (y compris un oreiller), un miroir et un bon éclairage. Vous mai effectuer ESB lorsque vous êtes sous la douche, certaines femmes trouvent que la main mouillée est utile pour détecter des changements dans leurs seins. N'oubliez pas d'effectuer l'ESB en position couchée, en plus de se lever. Seins sont des organes dynamiques et des changements peuvent se produire étapes de la vie par mois et tout au long (adolescence, maternité, ménopause). US Food and Drug Administration a approuvé des aides à l'ESB qui sont conçus pour améliorer la sensation tactile. C'est une bonne idée de tracer une esquisse de ce que vous ressentez dans votre ESB et de marquer votre calendrier. Gardez à l'esprit que la plupart des tumeurs mammaires ne sont pas cancéreuses. En fait, il a été estimé que seulement une en 11 morceaux est une tumeur. L'ESB est libre et non-toxique, et certains médecins pensent que l'ESB contribue à habiliter les femmes à prendre le contrôle de leur propre santé. Une bonne auto-examen mensuel des seins, quelques jours après la fin du cycle menstruel et l'examen clinique des seins par un professionnel de la santé formés une fois par an, est proposée. Des mesures pour auto-examen des seinsMammographie: La majorité des femmes diagnostiquées avec un cancer du sein n'ont pas de facteurs de risque évidents. En 1966, Macdonald estime cancer invasif temps de doublement à la gamme de 23 à 209 jours, avec une moyenne de 128 jours pour un cancer localisé et 85 jours pour un cancer métastatique. Un graphique basé sur le calcul mathématique du temps de doublement de 100 jours ont révélé une durée de 8 ans phase pré-clinique et une année à 4 cliniques de phase de la croissance du cancer du sein, qui se produit avant que la taille habituelle lorsque le cancer du sein est diagnostiqué. Le dépistage par mammographie pourrait identifier une masse non palpable d'environ 1 mm à 1 cm au cours de sa phase pré-clinique 3 ans avant qu'il devient palpable (2). La plupart des études de mortalité mammographie utiliser comme point final, donc la valeur du dépistage est souvent uniquement en fonction des taux de mortalité. Peu d'études prennent en compte les effets de la détection précoce sur la qualité de la vie ou du fait que le traitement à des stades précoces comporte moins de morbidité. En 1982, le Breast Cancer Detection Demonstration Project établi l'applicabilité du dépistage du cancer du sein par mammographie pour identifier des lésions non palpables. The 5-résultat de l'année a montré que 8,7% des cancers du sein ont été détectés par l'examen physique seulement, 41,6% ont été détectées par la mammographie seule, et 47,3% ont été détectées par la mammographie et l'examen physique. Du cancer du sein infiltrant inférieure à 1 cm, 52,6% ont été détectés uniquement par la mammographie. Parmi les 4240 femmes chez qui un cancer du sein a été dépisté et traité, les 10 taux de survie à un an était de 79% (3). Sur la base du régime d'assurance maladie de Greater New York and Breast Cancer Detection Demonstration données du projet, la direction estime à temps (le temps entre la détection sur la mammographie et quand la lésion est cliniquement décelable) pour le cancer du sein invasif est de 1,7 ans (extrêmes: 0,4 -3 ans), ce qui suggère que l'intervalle de dépistage optimale serait pas plus de 1,7 ans. La majorité de la mammographie de dépistage des essais cliniques avaient une limite supérieure des critères d'âge allant 64-74 ans. Medical co-morbidité et l'espérance de vie devrait être envisagée dans un cancer du sein, programme de dépistage pour les femmes âgées de 75 ans ou plus parce que les avantages / risques de la mammographie de dépistage continue de se déplacer de façon préjudiciable avec l'âge. Un consensus de recommandations n'existe pas. Cependant, la méta-analyse a conclu que la mammographie de dépistage chez les femmes âgées de 70-79 ans est modérément rentable et produit une faible augmentation de l'espérance de vie (3). Recommandations pour le dépistage du cancer du sein:
Conséquences néfastes du dépistage par mammographie: Les premières préoccupations au sujet du risque de rayonnement (par exemple, l'induction de cancer du sein par des radiations) ont été largement dissipées par des améliorations dans la technique de la mammographie, la technologie et l'expérience clinique. Faux-mammographies positives (par exemple, les personnes ayant perçu des anomalies nécessitant une évaluation plus poussée afin de vérifier que la lésion n'est pas un cancer) sont une préoccupation constante. Faux-la mammographie de dépistage positifs nécessitent une mammographie diagnostique avec des vues complémentaires, l'échographie et même la biopsie dans 20-30% des cas dans une tentative de parvenir à un diagnostic précis. Conséquences psychologiques du dépistage par mammographie ont été identifiés et examinés et ces psychologiques, comportementales et de qualité de questions de la vie semblent faire partie intégrante de la peur du cancer du sein. Autres Techniques de présélection: L'échographie est un complément à la mammographie établie dans l'évaluation d'imagerie. Il est utile dans l'évaluation des résultats peu concluants de mammographie, pour évaluer les patients jeunes et d'autres femmes par des tissus mammaires denses, à base de tissus de guidage-biopsie à l'aiguille et autres techniques de biopsie, et à différencier un kyste à partir d'une masse solide. Fine-needle aspiration cytology, notamment en Europe, a remplacé la biopsie chirurgicale pour l'évaluation des anomalies mammographiques. Plusieurs fois, un diagnostic définitif n'est pas possible, principalement en raison de son incapacité à différencier envahissantes de carcinome in situ. Stéréotaxique guidée biopsie à l'aiguille de base (CNB), qui utilise une aiguille de gros calibre, semble avoir plusieurs avantages par rapport fine needle aspiration cytology. CNB est moins coûteuse que la biopsie chirurgicale, des résultats en moins de morbidité, et ne laisse aucune cicatrice visible. Certaines lésions bénignes ont une incidence relativement élevée de carcinome coexistent, et le CNB avec son petit volume du tissu mai ne pas être suffisant pour écarter le cancer. L'imagerie par résonance magnétique peut être un complément utile à la mammographie de diagnostic, mais le coût, la durée de l'examen, et l'injection de produit de contraste interdit son utilisation comme une technique de routine, dépistage en population. L'écho-doppler couleur, détection assistée par ordinateur, la tomographie par émission de positons, scintigraphie, mammographie, étape par mammographie oblique, et la thermographie sont révélés prometteurs pour particuliers, certaines situations, mais restent sous investigation clinique et n'ont pas proposé que des techniques de dépistage efficaces. Ductal-Lavage à la détection du cancer du sein: Bien que les études d'imagerie actuels se sont avérés efficaces pour identifier les tumeurs malignes, elles ont une capacité limitée à détecter dans les lésions in situ. Ductoscopy est invasive, et nécessite une sédation et l'anesthésie. Diverses procédures sont disponibles pour obtenir des cellules canalaires à l'évaluation, telles que la collecte de liquide aspiré mamelon (NAF), Random périaréolaire aspiration à l'aiguille fine, et Ductal-lavage. Le mamelon maternel contient en moyenne cinq à neuf lait pores. Chaque pore est prolongé par un conduit central, qui a latérales unité lobulaire, où le lait est produit pendant la lactation. La fin lobules dans l'unité canalaire lobulaire administration, où le lait est produit pendant la lactation. Des recherches ont suggéré que l'atypie cellulaire est biomarqueurs significatifs qui précède la plupart des lésions malignes, et est hautement prédictif du développement du cancer du sein. Compte tenu de la théorie selon laquelle les conduits d'actifs sont plus susceptibles de produire des cellules, les patients doivent également être choisis en fonction de leur capacité de rendement de l'aspiration de liquide mamelon (NAF) avec aspiration aspirant doucement. Ce processus identifie également l'orifice de fluide rendement des conduits pour le lavage. Pour effectuer un lavage canalaire, anesthésique local est appliqué, et l'orifice canalaire canule avec un cathéter souple micro-entreprises. Anesthésique est alors souvent infusé à travers le cathéter pour insensibiliser la gaine. Saline est infusé de rincer à travers l'unité canalaire lobulaire, puis le liquide est recueilli. Le spécimen est prêt à la norme Pap coloration, et évalué cytologiquement. Ductal lavage doit être utilisé en conjonction avec, et non en lieu et place de l'examen clinique des seins et la mammographie. L'American Cancer Society (ACS) croit que le lavage canalaire mai être utile pour aider le petit groupe de patients à haut risque de continuer à évaluer leurs risques et prendre des décisions concernant le tamoxifène, traitement hormonal, et la prophylaxie chirurgicale. La Société américaine des chirurgiens du sein a également publié une déclaration officielle en faveur lavage canalaire. Le dépistage génétique du cancer du sein: Cellules ont deux copies - BRCA1 et BRCA2, et ils sont des gènes suppresseurs de tumeurs. Produits protéiques de ces gènes interagissent les uns avec les autres dans une voie qui répare l'ADN endommagé. BRCA1 - 2 mutations augmentent le risque de plus de cancers que d'autres facteurs et ces mutations augmentent le risque de cancer précoce du sein apparition. En dépit d'une estimation 50-80% de risque de cancer du sein pour ceux qui portent la mutation du gène BRCA1 ou BRCA2, peu ont prévenue que toute évolution de la population basée sur des lignes directrices pour le dépistage par mammographie dans ce groupe à haut risque. Niveau Reconnaissant qu'aucune données de surveillance ou des essais cliniques liés sont disponibles pour les transporteurs du gène BRCA1 ou BRCA2, le cancer génétique Studies Consortium a offert-III recommandations provisoires sur 1) l'éducation concernant l'auto-examen mensuel des seins, 2) l'auto annuelles ou semestrielles d'examen clinique des seins dès l'âge de 25-35 ans, et 3) la mammographie annuelle dès l'âge de 25-35 ans (4). Leçons tirées des essais BRCA:
L'incidence des mutations BRCA1 et 2 dans la population ashkénaze est de 1 / 40 et à la non-Ashkenazi population, il est 1 / 400-1 / 800. Si toutes les femmes ashkénazes être projeté pour des mutations du gène BRCA fondateur? Les arguments en faveur sont les suivants: il identifie les porteurs de la mutation rapide, menant à la prévention ou le diagnostic précoce. La discrimination génétique est peu susceptible d'être une préoccupation. Les arguments contre sont: des faux-négatifs si les mutations seul fondateur sont filtrés et faux sentiment de sécurité pour ceux dont le test est négatif et comportent un risque de base de cancer. La couverture d'assurance est largement disponible pour les tests génétiques. 97% des réclamations d'assurance accomplies en 2000-2001 ont été remboursés à un taux moyen de remboursement de 94%. Beaucoup de compagnies d'assurance ont établi des lignes directrices pour déterminer l'admissibilité pour le counseling et les tests. L'assurance-maladie paie maintenant pour les tests. Les prestations sont: il fournit des renseignements sur les risques pour les individus et les familles, fournit des informations utiles dans les soins de santé et les résultats peuvent atténuer l'incertitude et l'anxiété. Des limites sont: un résultat négatif est la plus définitive s'il existe une mutation connue dans la famille. Certaines variantes génétiques ont une signification clinique inconnue. Chimioprévention: La recherche de moyens pour prévenir le cancer du sein est en cours depuis de nombreuses années. Tamoxifène (un triphenylethylene), qui est un anti-strogène, même si elle est chimiquement lié à un estrogène, était vraiment le premier modulateur sélectif des récepteurs d'estrogène. Il ya eu plus d'un quart de siècle d'expérience avec le tamoxifène comme traitement adjuvant chez les patients atteints de cancer du sein. Parce que des données suggèrent une protection considérable dans le développement du cancer du sein controlatéral chez les femmes recevant du tamoxifène par rapport à ceux ne recevant pas le tamoxifène, un grand essai de prévention du cancer du sein (P-1) a été commencée en 1992 (National Surgical Adjuvant Breast Project [NSABP] / NCL) . Le modèle de Gail, un algorithme d'estimation du risque de cancer du sein, détermine un risque élevé. Le modèle de Gail est destiné aux femmes dans un programme de dépistage annuel de la mammographie. Gail modèle pour déterminer le risque de cancer du sein (5):
Ce modèle prédit le risque de cancer du sein en 5 ans ou l'espérance de vie. Plus récemment, les oestrogènes modulateurs sélectifs des récepteurs sont devenues disponibles pour évaluation, le raloxifène est le plus étudié. Cette drogue a été principalement utilisée pour déterminer la prévention de l'ostéoporose post-ménopausique chez les participants des résultats multiples de raloxifène Evaluation (MORE) qui ont été traités pendant 3 ans. Le risque de cancer du sein invasif était de 76% inférieure dans le groupe raloxifène que dans le groupe placebo. Cela a été attribué à une diminution de 90% dans le développement des tumeurs strogène-récepteur-positif. Ces résultats ont conduit à l'étude du tamoxifène et le raloxifène (STAR) d'essai pour l'évaluation de ces médicaments dans la prévention du cancer du sein invasif chez les femmes ménopausées qui sont à haut risque pour cette maladie. Autres estimateurs de risques possibles et les outils de diagnostic: Hyperplasie atypique: elle survient tôt dans le continuum des modifications histologiques qui constituent le processus de transformation vers le phénotype malin. Un histologique ou cytologique de trouver atypie est un important facteur de risque de développer un cancer du sein. Le risque a plus que doublé pour les femmes ayant des antécédents familiaux de cancer du sein (risque relatif: atypie seul, ~ 5; atypie + antécédents familiaux, 11-18), et environ 40% de ces femmes développent un cancer du sein dans leur vie. Hyperplasie atypique peut être utilisée comme un estimateur de risque de développer un cancer du sein, puisque la plupart des cancers du sein suivants surviennent dans les 5 années suivant le diagnostic (6). 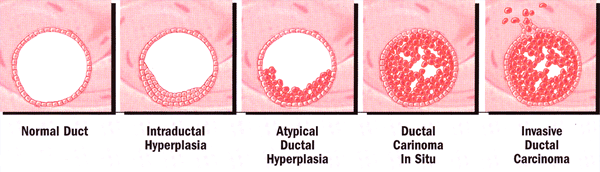 Développement de l'hyperplasie canalaire à la maladie invasive Densité mammographique du sein: la densité des seins de femme peut être évaluée sur une mammographie de routine et a été montré une corrélation avec le risque de cancer du sein. Le motif du parenchyme mammographie (densité du sein) se réfère à la quantité de tissu conjonctif et glandulaire par rapport aux tissus gras dans le sein. Étant donné que les cancers du sein sont également composées de tissu dense, la densité mammaire élevée peut tumeurs masque sur la mammographie, visant à empêcher leur détection précoce. Haute densité mammaire est également un facteur de risque pour le cancer du sein, mais mai être indépendante de l'exposition aux strogènes ou le statut des récepteurs d'estrogènes (7). Ainsi, le risque accru de cancer du sein associé à la densité du sein peut aussi résulter de facteurs non-oestrogénique, comme les niveaux d'insuline-like growth factor, l'alimentation, et / ou génétiques et facteurs environnementaux. La densité des seins varie sensiblement entre les femmes et peuvent avoir une haute (~ 63%) héritabilité. Informatisé d'analyse de texture des images mammographiques démontré que les modèles du parenchyme chez les femmes à haut risque qui sont porteuses de mutations des gènes BRCA1 ou BRCA2 sont denses, plus grossier, et avait un contraste plus faible avec moins de variations locales que ceux des femmes à faible risque de développer un cancer du sein (8) . Histologique et l'analyse cytologique pour le risque de cancer du sein: la détection de cellules anormales dans le sein a été révélée être un facteur de risque de cancer du sein. Il existe une variété de méthodes différentes pour obtenir un échantillon provenant du sein. Les méthodes traditionnelles de collecte de cellules pour la biopsie histologique ou l'analyse cytologique - aspiration à l'aiguille fine (FNA), la ponction du mamelon, biopsie à l'aiguille de base, et chirurgicaux - tous ont des limites (9). L'échantillonnage aléatoire avec FNA, par exemple, est une procédure invasive et donne souvent insuffisante pour l'analyse des tissus, en particulier chez les femmes âgées. De même, les aspirations du mamelon contiennent souvent des cellules insuffisants. Procédures Core biopsie à l'aiguille et la biopsie chirurgicale rendement des cellules amples, mais elles sont envahissantes qui ne serait pas faite uniquement pour l'évaluation des risques. Un nouvelle méthode moins invasive utilisée pour l'analyse histologique ou cytologique est un lavage canalaire, qui est une procédure très peu invasive que les extraits fluides Ductal l'aide d'un anesthésique topique et peut être réalisée en consultation externe. Parmi les candidats possibles pour le lavage canalaire sont des femmes qui sont estimées par le modèle de Gail d'être à risque accru de développer un cancer du sein. Imagerie du sein: il a été un outil pour prédire la probabilité de diagnostiquer le cancer du sein. The Breast Imaging Reporting and Data System (BI-RADS), développé par l'American College of Radiology, standardisée à l'évaluation des images pour aider à déterminer le suivi approprié. Anomalies suspectes - des lésions qui nécessitent une intervention (par exemple, biopsie), mais ne sont pas forcément malignes - sont affectés à la catégorie 4. Dans une étude réalisée pour évaluer l'utilisation du modèle de Gail comme adjuvant à la BI-RADS score, les femmes ayant des lésions de la catégorie 4 et d'une élévation de 5 ans Gail risque (> 1,7%) avaient des résultats nettement plus malignes à la biopsie que ceux avec lésions catégorie 4 et Gail risque faible (42% vs 21%, p <.0001, risque relatif 1,94). Les enquêteurs ont émis l'hypothèse que la méthode de mai le plus utile lorsqu'elle est appliquée à BI-RADS catégorie 3 lésions, mais le nombre de femmes dans cette catégorie était trop petite pour l'analyse (10). L'utilisation de l'imagerie du sein en tant que complément au modèle de Gail pour renforcer l'évaluation des risques nécessite une analyse plus approfondie. Améliorer le respect des recommandations: Selon les théories de comportement, la perception d'un risque plus élevé augmenterait le recours au dépistage, tandis que la perception d'un risque plus faible aurait l'effet inverse. Même si cela est vrai dans de nombreux cas, la question est complexe. Études ont montré que la réduction d'une femme risque perçu n'a pas nui à sa volonté d'obtenir une mammographie et mai ont augmenté le respect des recommandations de dépistage. Le cancer du sein de détresse psychologique liée (par exemple, l'inquiétude grave) a été associée à une mauvaise observance des recommandations de dépistage, même chez les femmes identifiées comme étant à risque élevé, tandis que vous inquiétez modérée a été associée à plus forte probabilité de dépistage. Il a été constaté que la relation entre vous soucier du risque de cancer du sein et la mammographie S'y est associé à un U inversé tracé en forme. Les femmes ayant des niveaux modérés de préoccupation étaient plus susceptibles d'avoir des mammographies régulièrement que ceux niveau de préoccupation était très bas ou très élevé. Les enquêteurs ont émis l'hypothèse que l'inquiétude grave déni et déclencheurs des comportements d'évitement, alors que la vigilance préoccupation modérée et motivation à utiliser des méthodes de dépistage (11). Le conseil génétique peut fournir une évaluation critique de l'histoire de la famille pour aider à déterminer la probabilité d'un syndrome de prédisposition héréditaire de cancer et la pertinence des tests génétiques. Les recommandations cliniques subséquentes pour porteur de la mutation nécessaire de prendre en compte l'âge du patient, le désir de procréer avenir, et les antécédents médicaux au moment de prescrire d'autres mesures de dépistage ou de la chirurgie prophylactique (12). Les applications pratiques des tests génétiques de susceptibilité au cancer ont la capacité de réduire le fardeau des cancers héréditaires, en sauvant des vies, diminuer les morbidités médicales, et réduire le stress psychologique. Héréditaire du sein et du cancer de l'ovaire:Héréditaire du sein et le cancer de l'ovaire est un cancer héréditaire syndrome de susceptibilité. Les caractéristiques de ce syndrome sont les membres de famille avec le cancer du sein ou des ovaires ou les deux, la présence de cancer du sein et le cancer de l'ovaire chez un seul individu, et l'âge précoce de survenue de cancer du sein (souvent avant l'âge de 50 ans). La grande majorité des cancers héréditaires du sein et le cancer de l'ovaire est due à une altération ou une mutation des deux gènes BRCA1 ou BRCA2. Ces mutations peuvent être héritées de la mère ou au père. Les stratégies actuelles pour réduire le risque de développer un cancer du sein chez les femmes présentant des mutations délétères du gène BRCA connus comprennent la surveillance, la chimio-prévention et la chirurgie. Recommandé surveillance comprend l'examen clinique des seins deux fois par an, ainsi que la mammographie et annuels sein d'imagerie par résonance magnétique dépistage dès l'âge de 25 ans ou plus tôt dès le début basée sur l'âge dans la famille (14). Examen d'imagerie par résonance magnétique est plus sensible pour la détection du cancer du sein que la mammographie, et la combinaison de l'imagerie par résonance magnétique, la mammographie, et clinique du sein a la plus haute sensibilité pour la détection du cancer du sein chez les porteurs à haut risque de mutation du gène BRCA. Salpingo réduction du risque-ovariectomie réduit le risque de cancer du sein de 40-70% (13). Cette protection apparaît probable que si les patients sont ménopausées au moment de la réduction des risques salpingo-ovariectomie. En outre, des études ont montré les porteurs de mutations BRCA1 mai ont moins d'un effet protecteur en réduisant le risque salpingo-ovariectomie sur le risque de cancer du sein que les porteurs de la mutation BRCA2 (14). Il est important pour les personnes à haut risque à rester en contact avec des cliniciens expérimentés dans les soins aux femmes à risque accru, étant donné le développement rapide de la recherche et le raffinement dans la technologie de test. Par exemple, un test pour grands réarrangements dans les gènes BRCA1 et BRCA2 a été développé qui mai aider à identifier des mutations dans un faible pourcentage des familles à haut risque qui ont déjà testé négatif pour ces gènes. Une évaluation du risque génétique est recommandé pour les patients avec un plus grand que une chance d'environ 20-25% d'avoir une prédisposition génétique au cancer du sein et le cancer de l'ovaire. Le modèle de Gail est un outil validé pour les femmes de race blanche que l'estimation du risque absolu d'une femme de développer un cancer du sein invasif dans les 5 prochaines années en fonction des facteurs de risque décrits ci-dessus. Il n'ya pas d'outil unique capable de prédire avec précision où les femmes auront un cancer du sein. Institut national du cancer du cancer du sein outil d'évaluation des risques et calculateur de risque sont disponibles sur: http://www.cancer.gov/bcrisktool/ Résumé: Les femmes âgées de 40-49 ans devraient subir un dépistage par mammographie tous les ans 1-2. Les femmes âgées de 50 ans et plus devraient avoir une mammographie annuelle. Malgré l'absence de données définitives pour ou contre l'auto-examen des seins, l'auto-examen des seins (AES) a le potentiel pour détecter le cancer du sein palpable et devrait être recommandé. Toutes les femmes doivent subir un examen clinique des seins chaque année dans le cadre de l'examen physique. Quand une masse non palpable est perçue sur la mammographie de dépistage, le patient doit être orienté vers un professionnel expérimenté dans le diagnostic du cancer du sein, de sorte que l'uvre d'imagerie médical complet peut être effectué. La mammographie est utile pour évaluer les femmes qui pensent avoir une masse du sein que le clinicien ne peut palper. Dans de tels cas, centrée échographie mai être une composante de l'évaluation d'imagerie complète à tout âge. Une masse non palpable mai exigent biopsie à l'aiguille de localisation ou biopsie stéréotaxique. Femmes mai profiter de conseils et les tests génétiques si leurs antécédents familiaux, notamment l'âge au moment du diagnostic et des types de tous les cancers (dans n'importe quelle famille, féminine et masculine), suggère un schéma possible de cancer autosomique dominante ou si une mutation BRCA a été découverte dans leur famille . Le conseil génétique se penchera sur les risques et les avantages de l'essai. Suggestions de lecture:
Références:
|