Pérdida recurrente de embarazo
WHEC Boletín Práctica Clínica y Gestión de los proveedores de salud. Educación subvención prevista de Salud de la Mujer y el Centro de Educación (WHEC).
Pérdida recurrente de embarazo (RPL) es un problema frustrante para los pacientes y médicos. El aborto espontáneo o aborto involuntario se define como la pérdida del embarazo antes de 20 semanas de gestación o el peso fetal de 500 gramos o menos. El embarazo es un proceso complejo, con muchas interacciones complejas entre el feto y el entorno materno. La pérdida del embarazo puede ser resultado de cualquier número de factores genéticos, endocrinos anatómica, enfermedades inmunitarias o trombóticos, así como por causas desconocidas (1). A pesar de una evaluación integral, la causa de la pérdida recurrente de embarazo (RPL) no se puede identificar más de la mitad de las parejas afectadas. Tranquilidad cautela y el apoyo son importantes - como es el monitoreo cuidadoso. Las pérdidas recurrentes del embarazo (RPL) no implica inevitabilidad. Incluso cuando los pacientes tienen RPL sin una etiología conocida, los resultados futuros, no puede ser deprimente. Al considerar la probabilidad de pérdida del embarazo sin tener en cuenta el diagnóstico específico, una mujer que no ha tenido pérdidas durante el embarazo tiene una probabilidad del 15% de la pérdida con el siguiente embarazo. Para una mujer con una pérdida antes de explicación, el riesgo de pérdida con el siguiente embarazo se eleva al 13% y un 30% con dos derrotas inexplicables. Incluso con pacientes que han tenido cuatro abortos antes, sin embargo, la posibilidad de realizar el siguiente embarazo a término es de 60% (2). Los aspectos más importantes del manejo del paciente con RPL son frecuentes comunicaciones, educación y apoyo emocional. Tranquilidad cautela debe ser ofrecido como la gran mayoría y un 70% de los pacientes en última instancia, lograr un embarazo exitoso. Monitoreo cuidadoso se justifica porque las mujeres con RPL también están en mayor riesgo de otras complicaciones del embarazo, como parto prematuro y embarazos ectópicos.
El propósito de este documento es describir las causas de la pérdida recurrente de embarazo (RPL) y sus posibles tratamientos, en su caso. La reproducción humana es un proceso ineficiente. Sólo el 15% al 30% del resultado fecundados los ovocitos en el embarazo viable. Después de una evaluación completa y el éxito del tratamiento, las parejas que han experimentado un aborto espontáneo a menudo tienen miedo de quedarse embarazada de nuevo. Estos pacientes necesitan apoyo médico intensivo durante el primer trimestre. Esta revisión puede servir como un recurso útil para asesorar a los pacientes sobre las opciones de tratamiento.
Definición
Pérdida recurrente de embarazo (RPL) se define actualmente como tres o más abortos consecutivos de los embarazos reconocidos clínicamente antes de la semana 20 de gestación (no incluye - embarazos bioquímicos, ectópicos y molares). Aproximadamente el 2% de las mujeres tienen dos abortos consecutivos. Tradicionalmente, RPL, que afecta aproximadamente al 1% de las parejas, se refiere a la pérdida de tres o más embarazos consecutivos. Sin embargo, el riesgo de pérdida en el tercer después de dos abortos involuntarios es de aproximadamente 30%, mientras que el riesgo después de tres derrotas es de aproximadamente 33% (3). Debido a esta diferencia es muy pequeña, muchos médicos se iniciará la evaluación de los RPL después de dos derrotas. Este enfoque puede ser especialmente útil en las mujeres mayores. RPL primaria se refiere a pacientes que nunca han logrado el embarazo, mientras que RPL secundaria se refiere a aquellos en los que los abortos involuntarios seguir al menos un embarazo normal. El riesgo de aborto involuntario es menor en mujeres que llevan por lo menos un embarazo a término, mientras que una historia de aborto involuntario aumenta el riesgo de aborto involuntario en los embarazos posteriores. Edad de la madre también es un fuerte predictor de las pérdidas recurrentes.
Epidemiología
De los embarazos clínicamente reconocidos, el 10% a 15% resulta en aborto espontáneo. La mayoría de estos abortos son clínicamente evidentes por 12 semanas de gestación. Muerte embrionaria o pre-embrión, por lo general ocurre al menos una semana antes de que las características clínicas de la pérdida del embarazo de ser reconocido. El riesgo de RPL se pensó para aumentar progresivamente con cada aborto espontáneo y de dar lugar a una mujer, con un 80% de probabilidades de un aborto espontáneo posteriormente, después de tres abortos espontáneos. En la actualidad, se cree que el riesgo espontáneo aumenta con el número de abortos, pero poco a poco muy, y rara vez supera el 40% a 50%. Para una mujer que ha tenido un nacimiento vivo, aunque ha tenido varios abortos espontáneos, su riesgo de aborto espontáneo en embarazos futuros es de 30% por el embarazo (4).
Etiología y Factores de Riesgo
Las siguientes causas de RPL son ampliamente aceptadas. El diagnóstico diferencial de RPL es negativa en más de 50% de los pacientes (5). Sin embargo, el embarazo con éxito se produce en hasta un 35% a 80% de las parejas que han sido evaluados para RPL, independientemente de la etiología y el tratamiento (5). Pareja con RPL inexplicables tienen posibilidades aún mayor de embarazo exitoso.
Etiología de la pérdida recurrente de embarazo
- Cromosómicas;
- Anatómica / uterino factores;
- Enfermedades infecciosas;
- Trastornos endocrinos;
- Alteraciones del sistema inmunológico;
- Trombofilias heredadas;
- Asociaciones ecologistas y otros.
Los factores de riesgo:
- Pérdida de un embarazo anterior;
- La edad materna avanzada;
- El aumento de la paridad - "compensación reproductiva"
- Resultado negativo del último embarazo;
- Avanzada edad gestacional al momento del siniestro (es).
Diagnóstico y Manejo
No hay un número específico de las pérdidas o criterio establecido firmemente que la evaluación de los jueces de RPL o define el alcance de las pruebas. Las decisiones deben ser individualizadas y la consideración de la edad de la mujer, el momento y las circunstancias de las pérdidas anteriores del embarazo, los elementos de la historia clínica personal y familiar, y el nivel de la pareja de la ansiedad se debe tener en cuenta. Investigación clínica y el tratamiento puede ser considerado en las parejas con dos derrotas consecutivas espontánea cuando cualquiera de los siguientes síntomas: actividad cardíaca embrionaria observada en la pérdida del embarazo antes; cariotipo normal de los productos de la concepción de una pérdida anterior, con una edad> 35 años, y la infertilidad .
Las anomalías cromosómicas
Las anomalías cromosómicas se producen en el 64% a 88% de los abortos espontáneos aislados (5)(6). De estos, un 62% a 70% son las trisomías autosómicas, 8% y el 20% son triploides o tetraploides, y el 6% están relacionadas con anomalías cromosómicas estructurales. La prevalencia de anomalías cromosómicas en el RPL es al menos el 50% y generalmente está relacionada con la edad materna. En los pacientes que se someten a fertilización in vitro (FIV), la insuficiencia de preimplantación se asocia con anormalidades cromosómicas en el 67% a 85% de los casos (7). Cariotipo de preimplantación de embriones de pacientes con aborto recurrente demuestra una tasa seis veces mayor de monosomías. Aneuploidía recurrente (número anormal de cromosomas) se puede demostrar en más de dos tercios de los embarazos posteriores después del diagnóstico en el primer embarazo. La etiología de las alteraciones cromosómicas no se conoce completamente. Anomalías que surjan durante la cuenta de la primera división meiótica de la mayoría de las aneuploidías. El mecanismo exacto por el cual esto ocurre está bajo investigación. Los factores genéticos que dependen de la edad, tales como sitios frágiles en los cromosomas, inversiones y translocaciones, representan el 3,5% al 4,4% del RPL de aneuploidía. De estos, desplazamientos son con mayor frecuencia en RPL. Hay dos tipos principales de translocaciones: recíproca, en el que dos segmentos de diferentes cromosomas se intercambian, y de Robertson, en la que no es la fusión en el centrómero de dos cromosomas acrocéntricos. Translocaciones equilibradas pueden resultar en portadores normales, pero puede dar lugar a reordenamientos desequilibrados en los hijos y el aborto involuntario de esta manera. La pérdida del embarazo es más común con translocaciones materna.
Frecuencia y distribución de anomalías cromosómicas en reconocidos clínicamente concepciones humanas (8):
| Abnormality | Spontaneous Abortion | Stillbirth | Live Birth | Probability of Survival at Term |
|---|---|---|---|---|
| All | 50 | 5 | 0.5 | 5 |
| Trisomy 16 | 7.5 | --- | --- | 0 |
| Trisomy 13, 18, 21 |
4.5 | 2.7 | 0.14 | 15 (3, 5, 22) |
| XXX, XXY, XYY | 0.3 | 0.4 | 0.15 | 75 |
| All other trisomies | 13.8 | 0.9 | --- | 0 |
| 45XO | 8.7 | 0.1 | 0.01 | 1 |
| Triploidy 3N | 6.4 | 0.2 | --- | 0 |
| Tetraploidy 4N | 2.4 | --- | --- | 0 |
| Structural | 2.0 | 0.8 | 0.3 | 45 |
Los factores uterinos
Congénitas y adquiridas en cuenta las anomalías uterinas del 10% al 15% de las mujeres con RPL y se identifican por sonohisterografía (SHG) o histerosalpingografía (HSG) (9). La resonancia magnética (MRI) puede ser necesario diferenciar con precisión útero bicorne y septado.
Anormalidades del tracto mülleriano: Anomalías congénitas del tracto mülleriano manifiesta como un espectro de hallazgos, de los tabiques parciales para completar la duplicación de la parte superior del tracto reproductivo (ver figura abajo). El útero septo es la anomalía más común de Müller, la más estrechamente relacionada con la pérdida del embarazo (65% tasa de aborto espontáneo), y la malformación más fácilmente y con éxito corregido por la septoplastia histeroscópica. Didelfo uterino y el útero bicorne se asocian con aproximadamente el 40% tasa de aborto espontáneo. Sin embargo, los procedimientos abdominales metroplastia raras veces están indicadas para las mujeres con un útero didelfo o un útero bicorne. El cerclaje cervical puede ayudar a mejorar los resultados del embarazo en mujeres con útero bicorne y en aquellos con un útero unicorne o un útero didelfo, que tienen un historial de entrega o exhibición previable acortamiento cervical progresiva durante el embarazo temprano.
n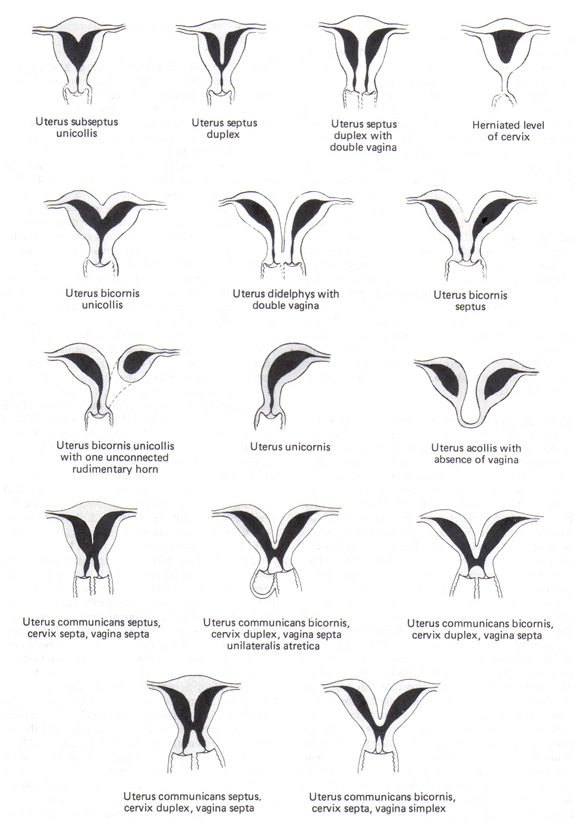
Figura 1. Anomalías congénitas del útero
Los fibromas uterinos y otros factores anatómicos: Los fibromas uterinos son frecuentemente identificadas en las mujeres con RPL, pero sólo los miomas submucosos y grandes miomas intramurales que invadir o deforman la cavidad uterina son significativas. Las adherencias intrauterinas son una causa poco frecuente, pero establecidos de RPL, con mejora de los resultados del embarazo después de la lisis histeroscópica. Por último, a pesar de dietilestilbestrol (DES) fue prohibido en 1971, las mujeres afectadas son todavía de vez en cuando visto. Aproximadamente el 70% de las mujeres expuestas a DES en el útero tiene una anomalía del desarrollo del útero y tienen un riesgo dos veces mayor de aborto espontáneo, un 24% (10). Cerclaje debe ser considerado en mujeres con antecedentes de exposición a DES y la pérdida de segundo trimestre o parto prematuro.
Enfermedades infecciosas
Aunque la infección es una causa frecuente de los últimos pobres resultados del embarazo en embarazo, ninguna asociación consistente entre las infecciones y RPL ha sido demostrada. Ni Chlamydia ni Mycoplasma, las causas más comunes de los nacimientos prematuros y otras complicaciones después del primer trimestre, se ha identificado de manera concluyente como causa de RPL. Estos, sin embargo, se asocia con la pérdida del embarazo no recurrentes o esporádicas. Las pruebas de rutina serológicos, cultivos cervicales, y una biopsia endometrial para detectar las infecciones genitales en mujeres con RPL no se justifican. Evaluación de la infección debe limitarse a las mujeres con cervicitis, la vaginosis bacteriana crónica o recurrente, u otros síntomas de infección pélvica.
Causas endocrinas
Trastornos endocrinos son causa relativamente infrecuente de RPL, pero incluyen: diabetes mellitus, enfermedad tiroidea subclínica, el síndrome de ovario poliquístico (SOP), hiperprolactinemia y defectos de la fase lútea. Evaluación de glucosa en la sangre y los niveles de hemoglobina A1C está indicado en mujeres con diabetes mellitus conocida o sospechada, pero por lo demás no se justifica. Se ha comprobado que un buen control la diabetes mellitus no aumenta el riesgo de aborto espontáneo. Trastornos de la tiroides son fáciles de identificar y tratar y debe ser excluida por hormona estimulante del tiroides (TSH) la medición, incluso anormalidades sutiles pueden afectar el resultado del embarazo, aunque existe controversia si existe una verdadera relación con RPL. Resistencia a la insulina se asocia también con RPL, y el SOP se ha asociado con aborto espontáneo. Esto puede ser mediada a través de una respuesta fibrinolítica con discapacidad como lo demuestra el hecho de que las mujeres con SOP y RPL tienen niveles elevados de inhibidor del activador del plasminógeno-1 (PAI-1) (11). Los niveles elevados de PAI-1 puede impedir la implantación del trofoblasto y la invasión mediado por la uroquinasa-activador del plasminógeno tipo. Otros factores que pueden embriotóxicos encuentra en exceso en el líquido folicular de pacientes SOP incluyen glucosa, insulina-como factor de crecimiento 1 (IGF-1), y los niveles de andrógenos. SOP por sí solas no predicen el riesgo de aborto involuntario. Sin embargo, la obesidad se asocian de forma independiente con la pérdida del embarazo. Retrospectivos y pequeños estudios caso-control han demostrado que la terapia con metformina reduce el riesgo de PRL en las mujeres con SOP del 42% al 62% a 26% al 29% (11). Grandes estudios prospectivos son necesarios para confirmar esta asociación. Niveles elevados de prolactina se han asociado con RPL, y el tratamiento con bromocriptina se ha demostrado que aumenta la probabilidad de un embarazo normal.
Insuficiencia luteínica
La incidencia de insuficiencia luteínica - verificado en la biopsia endometrial mediante la demostración de la falta de efecto de la progesterona se espera en el ciclo - es el mismo para mujeres en edad fértil como para aquellos con antecedentes de infertilidad (12). Por lo tanto, a pesar de la teoría razonable que la insuficiencia luteínica es una causa potencial de RPL, cómo se diagnostica sigue siendo incierto. La prevalencia de la insuficiencia luteínica, en la cual hay una deficiencia relativa de la progesterona, es del 2,5% en los pacientes RPL (12). Aunque gran parte de la literatura disponible ha sido contradictoria, una revisión Cochrane de 15 ensayos controlados aleatorios llegó a la conclusión que a partir de progesterona suplementaria en el primer trimestre del embarazo mejora los resultados para los pacientes con recurrencia, pero no aislada, la pérdida del embarazo en el primer o segundo trimestre (13 ). Teniendo en cuenta el beneficio de datos que indica para las mujeres con el segundo trimestre las pérdidas, por el cual la placenta se ha asumido el papel de la progesterona secreción, la teoría detrás de la eficacia de la progesterona en este establecimiento es su acción como un relajante del músculo liso. Vías de administración y dosis de progestágeno variaron entre los estudios revisados. Algunos estudios sugieren que la fecundación in vitro progestágeno oral es inferior a una formulación intramuscular (14). Sobre todo, con una población de infertilidad, es importante que con una suplementación temprana no comenzar demasiado pronto. Los datos muestran que la fertilización in vitro un endometrio excesivamente acelerado en realidad puede reducir la tasa de implantación del embrión. Por lo tanto, cuando la suplementación es siempre antes de un resultado positivo en la prueba de embarazo, la paciente debe ser la ovulación de vigilancia. Para los pacientes con RPL, sobre todo si se ha producido en el primer trimestre - la suplementación debe continuar al menos hasta la edad de gestación de 9 semanas. La implantación ocurre aproximadamente una semana después de la ovulación, pero no hay margen de maniobra en el tiempo. Ocasionalmente, los pacientes se olvida de tomar sus suplementos de progesterona hasta más tarde en el ciclo, y ninguna diferencia en las tasas de embarazo ha sido observado.
El tratamiento de la fase lútea defecto
Supositorios vaginales de progesterona: 25 mg dos veces al día a partir de 3 días después (LH), el aumento de la hormona luteinizante y continuando hasta ocho semanas de gestación;
La progesterona en aceite intramuscular (IM): 12,5 mg / día IM comenzando 3 días después del pico de LH y continuando hasta ocho semanas de gestación;
Progesterona micronizada: 200 mg / día por vía oral a partir de 3 días después del pico de LH y continuando hasta ocho semanas de gestación;
El citrato de clomifeno: 50 mg / día por vía oral durante 5 días, comenzando el día 3-5 del ciclo menstrual (no suplementación embarazo es necesario).
Factores inmunológicos
Ambos mecanismos autoinmunes y aloinmune están implicados como causas de RPL. Los trastornos autoinmunes involucran una respuesta inmune dirigida contra una parte específica de la máquina o por cuenta propia. Trastornos aloinmune impliquen un nivel de respuesta de la madre inmune a los antígenos del feto o la placenta materna incluyendo anticuerpos citotóxicos, en ausencia de anticuerpos maternos de bloqueo, y las alteraciones en la función de las células asesinas naturales y la distribución.
Enfermedades autoinmunes
Las enfermedades autoinmunes como el lupus eritematoso sistémico (LES) y el síndrome antifosfolípido (APLS) son trastornos identificables y tratables, y están asociados con RPL. El anticoagulante lúpico y anticuerpos anticardiolipina, los anticuerpos más ampliamente aceptado de uso clínico, y se han asociado con una variedad de problemas médicos, incluyendo trombosis arterial y venosa, trombocitopenia autoinmune, y la pérdida fetal (15). Además de la pérdida fetal, varias complicaciones obstétricas se han asociado con anticuerpos antifosfolípidos, como preeclampsia, restricción del crecimiento intrauterino, insuficiencia placentaria y parto prematuro.
Síndrome antifosfolípido (APLS)
El síndrome antifosfolípido (APLS) es un trastorno autoinmune se define por la presencia de características clínicas y niveles específicos de circulación de anticuerpos antifosfolípidos. Debido a que aproximadamente el 70% de las personas con APLS son mujeres (16), es bastante común entre las mujeres en edad reproductiva. Los anticuerpos antifosfolípidos son un grupo diverso de anticuerpos con la especificidad de unión a proteínas fosfolípidos de carga negativa en la superficie celular. A pesar de la importancia de la prevalencia y la clínica de las minas antipersonal, existe controversia acerca de las indicaciones para las pruebas de minas terrestres antipersonal y las pruebas que deben ser solicitados para el diagnóstico de la enfermedad. Gran parte del debate los resultados de la falta de estudios bien diseñados y controlados en el diagnóstico y tratamiento de las minas antipersonal (17). síndrome antifosfolípido primario se refiere a los pacientes con APLS, pero no reconoce otros trastornos autoinmunes (18). Sin embargo, otras enfermedades autoinmunes, como lupus eritematoso sistémico a menudo coexisten con la condición. Cuando se presenta en el contexto de una enfermedad autoinmune, que se conoce como síndrome antifosfolípido secundario(18). APLS definitiva se considera presente si al menos uno de los criterios clínicos y uno de los criterios de laboratorio se cumplen (17):
Clínica obstétrica:
- Tres o más abortos espontáneos consecutivos antes de la semana 10 de gestación;
- Una o más muertes inexplicables del feto a término o después de la semana 10 de gestación;
- Preeclampsia severa o insuficiencia placentaria que requieren luz antes de las 34 semanas de gestación.
La trombosis vascular:
- Trombosis venosa inexplicable;
- Trombosis arterial sin causa aparente;
- Trombosis de pequeños vasos en cualquier tejido u órgano, sin evidencia significativa de la inflamación de la pared del vaso.
Laboratorio
- Anticuerpos anticardiolipina de tipo IgG o IgM isotipo en medio de altos títulos, en dos o más ocasiones por lo menos 6 semanas de diferencia, medida por el estándar enzimático inmunoabsorbente;
- Presente anticoagulante lúpico en el plasma, en dos o más ocasiones por lo menos 6 semanas de diferencia, que se detectó acuerdo con las directrices de la Sociedad Internacional de Trombosis y Hemostasia, en los siguientes pasos:
- Demostración de un prolongado dependientes de fosfolípidos prueba de detección de la coagulación (por ejemplo, el tiempo de tromboplastina parcial activada, tiempo de coagulación de caolín, diluir la víbora de Russell tiempo veneno, diluir el tiempo de protrombina);
- La falta de corrección de la prueba de detección prolongada por la mezcla con normalidad plasma pobre en plaquetas;
- Acortamiento o corrección de la prueba de detección prolongada por la adición de fosfolípidos en exceso;
- La exclusión de otras coagulopatías (por ejemplo, inhibidores de factor VIII, heparina) que esté clínicamente indicado.
Gestión de las minas antipersonal durante el embarazo: Los objetivos del tratamiento para APLS durante el embarazo son mejorar los resultados maternos y fetales neonatales, al reducir el riesgo de pérdida del embarazo, preeclampsia, insuficiencia placentaria, y el nacimiento prematuro y para reducir o eliminar los riesgos trombóticos materna. Dos revisiones recientes (19) han hecho hincapié en que las series de casos y ensayos de tratamiento tienden a incluir a las personas cuya APLS diagnóstico se divide en dos grupos: aquellos con un historial de eventos trombóticos y los que no tienen una historia. Tratamiento de mujeres con APLS sin un evento trombótico es controversial. Un reciente meta-análisis sugiere que, para las mujeres con aborto involuntario recurrente como los criterios clínicos, la heparina profiláctica y dosis bajas de aspirina puede reducir la pérdida del embarazo en un 50% (20). Esta terapia combinada parece superior a la dosis baja de heparina sola o con prednisona. Para las mujeres con APLS sin antecedentes de un episodio trombótico, algunos médicos recomiendan el inicio de la heparina antes de la concepción, aunque ningún ensayo clínico con esta recomendación. La mayoría de los expertos recomiendan 6-8 semanas de la tromboprofilaxis después del parto en mujeres con complicaciones obstétricas APLS (21). Varios enfoques para el manejo perinatal de la anticoagulación en estos pacientes están disponibles. La dirección de nuestra institución es la siguiente:
- Heparina (10K-20K unidad subcutánea o HBPM 0.7mg/kg/day [heparina de bajo peso molecular] subcutánea), y / o
- La aspirina (81 mg) + heparina (arriba).
El tratamiento puede ser iniciado antes de la concepción que después de la viabilidad documentado con ninguna diferencia perceptible en los resultados (22). Otras terapias que se han sugerido para el tratamiento de mujeres embarazadas con APLS abarcan los corticosteroides y la inmunoglobulina intravenosa (IVIG). Varias series de casos han reportado una tasa de 60-70% de embarazos exitosos en mujeres con APLS tratados con heparina y bajas dosis de prednisona- (22). Debido a la eficacia de IGIV no se ha demostrado en estudios adecuadamente diseñados y el medicamento es muy caro, no se recomienda como tratamiento primario.
Trastornos aloinmune
La aceptación del aloinjerto fetal y placentario por los resultados del sistema inmunitario materno de la expresión de trofoblasto no inmunogénica HLA-G, ligando Fas, agentes inmunosupresores como la hCG, PAPP-A, y la progesterona y el aumento de los niveles de cortisol materno. Compartir HLA entre marido y mujer fue teorizada como resultado la ausencia de anticuerpos específicos del embarazo que protegía al feto de medio exterior de rechazo materno. Sin embargo, todos los métodos actuales para la evaluación de sospecha alloimmunopathology, incluidas las pruebas de HLA, la evaluación de células inmunes (cultivo mixto de linfocitos, células asesinas naturales ensayos), y las pruebas de citoquinas son de investigación. Ninguno de los dos principales inmunoterapias abogó por el tratamiento de trastornos aloinmune en las mujeres con la inmunización RPL, leucocitos paternos y la inmunoglobulina IV, han demostrado ser eficaces (23).
Trombofilias hereditarias
Trombofilias hereditarias como resultado de mutaciones genéticas en los factores de coagulación que conduce a la trombosis placentaria se han convertido en una causa potencialmente importante de RPL (24). Sin embargo, la mayoría de las mujeres con estas mutaciones tienen resultados reproductivos completamente normal. Las mujeres con más de un tipo de mutación o cuyo feto herede la mutación puede tener un riesgo mayor de aborto espontáneo. Las indicaciones para el cribado de las mujeres con RPL para el creciente número de trombofilias reconocido todavía no están establecidos. En la actualidad, el cribado parece apropiado para las mujeres con RPL no tiene otra explicación con una pérdida de sospechosos (después de 10 semanas de gestación o la detección de la actividad cardíaca embrionaria) o la historia de otras complicaciones del embarazo que pueden haberse debido a una insuficiencia placentaria o trombosis (preeclampsia, restricción del crecimiento intrauterino, desprendimiento de la placenta). Además de anticoagulante lúpico y anticuerpos anticardiolipina para el diagnóstico de trombofilia adquirida, la selección incluye pruebas para el factor V Leiden y la protrombina 20210A mutación genética. Son las dos causas hereditarias más comunes de la enfermedad tromboembólica venosa y la trombofilia más frecuentemente asociado con resultados adversos del embarazo (25). La prevalencia de estas mutaciones es relativamente alta entre las personas de ascendencia europea (hasta un 15%) pero muy bajo en los asiáticos, africanos y americanos nativos (25). Medición de la proteína C activada la resistencia es una prueba más global para la detección de las dos formas hereditarias y adquiridas de la proteína C activada la resistencia. La detección de la metileno tetrahidrofolato reductasa (MTHFR) mutación, homocisteína sérica y la antitrombina III, proteína S, proteína C y deficiencias también pueden merecer consideración, sobre la base de los antecedentes médicos y familiares (26).
Teniendo en cuenta los datos disponibles, no hay pruebas suficientes para apoyar la detección de trombofilia como parte de la evaluación inicial de RPL. Además, se desconoce si el tratamiento va a mejorar el resultado del embarazo en estas mujeres. Las pérdidas de embarazos más precoces son debido a la aneuploidía y lo ideal sería que todas las mujeres con RPL (y la muerte fetal) debe tener aberturas a completa, incluyendo el cariotipo de las pérdidas para excluir otras causas antes de atribuir las pérdidas de trombofilia. Trombofilias son convincentemente asociados con un mayor riesgo relativo de muerte fetal, pero no con los recurrentes en el primer trimestre de pérdidas. Del mismo modo, el tratamiento puede ayudar a las personas con trombofilia y la muerte fetal, pero el tratamiento no ha sido probado en mujeres con recurrencia en el primer trimestre la pérdida y la trombofilia. Los datos preliminares sugieren que el tratamiento combinado con aspirina y heparina puede mejorar los resultados del embarazo en mujeres con trombofilia RPL y potenciales, pero los ensayos controlados son necesarios.
Asociaciones del Medio Ambiente y otros
Fumar aumenta el riesgo de aborto espontáneo y debe ser evitado. El consumo de alcohol superior a dos bebidas al día y el consumo elevado de cafeína (más de 300 mg / día) puede aumentar el riesgo de pérdida del embarazo y es mejor evitarlos. Las toxinas ambientales, tales como metales pesados (mercurio, plomo), disolventes orgánicos (por ejemplo, perchlorethlene o limpieza en seco con solventes), la radiación ionizante y los gases anestésicos han sido implicados como agentes causales de aborto espontáneo (27). La exposición a los terminales de video, mantas eléctricas, o bolsas de agua caliente no está asociado con un mayor riesgo de RPL. Los programas de ejercicios no aumentan el riesgo y el reposo en cama no va a disminuir el riesgo de RPL.
| Recurrent Pregnancy Loss Checklist | ||
|---|---|---|
| Laboratory Tests | Date | Result |
| SHG or HSG | ||
| Karyotype ♀ ♂ |
||
| Fasting insulin/glucose; HbA1C | ||
| MTHFR (C677T or A1298C) | ||
| Homocysteine | ||
| PG20210A | ||
| Factor V Leiden | ||
| Protein C | ||
| Protein S | ||
| Antithrombin III | ||
| Lupus anticoagulant | ||
| Anticardiolipin antibodies IgG IgM |
||
| β2- glycoprotein-I antibodies IgG IgM |
||
| TSH | ||
| Thyroid peroxidase antibody | ||
| Prolactin | ||
| Tissue transglutaminase IgA/total IgA | ||
Abbreviations: SHG -- sonohysterography; HSG -- hysterosalpingography; MTHFR -- methylene tetrahydrofolate reductase; TSH -- thyroid stimulating hormone;
Seguimiento
Después de una evaluación completa y el éxito del tratamiento, las parejas que han experimentado un aborto espontáneo a menudo tienen miedo de quedarse embarazada de nuevo. Estos pacientes necesitan apoyo médico intensivo durante el primer trimestre. Es útil para informar a las parejas que el riesgo de aborto espontáneo disminuye a medida que aumenta la duración del embarazo: la observación de un saco gestacional (12%), del saco vitelino (8%), grupa embrionarias corona aumenta la longitud (> 5 mm, 7%; 6.10 mm, 3%;> 10 mm, <1%). La observación de la actividad cardíaca embrionaria de gestación de 6 semanas reduce el riesgo de aborto espontáneo y el 3% - 5%. Sin embargo, la incidencia de aborto espontáneo posterior es mayor cuando existen otros hallazgos anormales ecográficos: discrepancias lentas o tardías que aparecen actividad cardiaca, tamaño y / o fecha, o hematoma subcoriónico. Por último, el valor pronóstico de la actividad cardíaca embrionaria disminuye al aumentar la edad de la madre de la tasa de aborto espontáneo de menos de 5% en las mujeres menores de 35 años al 29% en mujeres mayores de 40 años y más.
Resumen
El aborto espontáneo es la complicación más común del embarazo. 40% al 50% de conceptuses se pierden antes de la menstruación se esperaba, y el 30% a 35% se pierde en la menstruación o después de perder. Tradicionalmente, la pérdida del embarazo recurrente (RPL) se refiere a la pérdida de tres o más embarazos consecutivos, sin embargo, muchos médicos se iniciará la evaluación de los RPL después de dos derrotas, porque el riesgo de una tercera derrota después de dos abortos involuntarios es de aproximadamente 30%, mientras que el riesgo después de tres derrotas es de aproximadamente 33%. Este enfoque puede ser especialmente útil en las mujeres mayores. El riesgo de aborto involuntario es menor en mujeres que llevan por lo menos un embarazo a término, mientras que una historia de aborto involuntario aumenta el riesgo de aborto involuntario en los embarazos posteriores. Edad de la madre también es un fuerte predictor de la pérdida recurrente. Las principales causas de RPL se cromosómicas, anatómicas / uterinos, endocrinos, inmunológicos y trombofilia. La evaluación de la pareja con RPL debe incluir lo siguiente: cariotipos los padres, la evaluación del útero con sonohisterografía (SHG), HSG, y / o la histeroscopia, la evaluación de las minas antipersonal: anticoagulante lúpico, anticuerpos anticardiolipina, anticuerpos-β2-glicoproteína I, un estudio diagnóstico de trombofilias heredadas si las pérdidas se han producido después de 10 semanas, y el nivel de prolactina en suero. El diagnóstico diferencial de RPL es negativa en más de 50% de los pacientes. Sin embargo, el embarazo con éxito se produce en hasta un 35% a 80% de las parejas que han sido evaluados para RPL, independientemente de la etiología y el tratamiento. Es importante recordar que las parejas que están siendo evaluados para RPL tienen altos niveles de depresión y estrés. Algunos estudios han indicado que el apoyo psicológico puede reducir las tasas de aborto involuntario inexplicable. Por último, los pacientes deben estar seguros de que incluso sin tratamiento, embarazo exitoso ocurre en la mayoría de los casos.
Referencias
- Jaslow CR, Carney JL, Kutteh WH. Diagnostic factors identified in 1020 women with two versus three or more recurrent pregnancy losses. Fertil Steril 2010;93(4):1234-1243
- Speroff L, Glass R, Kase N. Clinical Gynecologic Endocrinology and Infertility. 6th ed. Philadelphia, PA: Lippincott Williams & Wilkins; 1999
- ACOG Practice Bulletin. Management of recurrent pregnancy loss. Number 24, February 2001. (Replaces Technical Bulletin Number 212, September 1995). American College of Obstetricians and Gynecologists. Int J Gynaecol Obstet 2002;78:179-185
- Cramer DW, Wise LA. The epidemiology of recurrent pregnancy loss. Semin Reprod Med 2000;18:331-339
- Sfakianaki AK, Lockwood CJ. In High Risk Obstetrics -- the requisites in Obstetrics and Gynecology; Recurrent pregnancy loss. 2008; p.147. Publisher: Mosby, Elsevier
- Dhont M. Recurrent miscarriage. Curr Women's Health Rep 2003;3:361-366
- Baart EB, Martini C, van den Berg I, et al. Preimplantation genetic screening reveals a high incidence of aneuploidy and mosaicism in embryos from young women undergoing IVF. Hum Reprod 2006;21:223-232
- Kodaman PH. Recurrent pregnancy loss. Yale CME Frontiers of reproduction at Yale 2011: fertility and women's health. April, 29, 2011
- Propst Am, Hill JA. Anatomic factors associated with recurrent pregnancy loss. Semin Reprod Med 2000;18:341-350
- Saravelos SH, Cocksedge K, Li TC. The pattern of pregnancy loss in women with congenital uterine anomalies and recurrent miscarriage. Reprod Biomed 2010;20(3):416-422
- Lee RM, Silver RM. Recurrent pregnancy loss: summary and clinical recommendations. Semin Reprod Med 2000;18:433-440
- Coutifaris C, Myers ER, Guzick DS, et al. Histological dating of timed endometrial biopsy tissue is not related to fertility status. Fertil Steril 2004;82(5):1265-1272
- Haas DM, Ramsey PS. Progestrogen for preventing miscarriage. Cochrane Database Syst Rev. 2008;16(2): CD003511
- Penzias AS. Luteal phase support. Fertil Steril 2002;77(2):318-323
- Levine JS, Branch DW, Rauch J. The antiphospholipid syndrome. N Engl J Med 2002;346:752-763. (Level III)
- Lockshin MD. Antiphospholipid antibody. Babies, blood clots, biology. JAMA1997;277:1549-1551. (Level III)
- ACOG Practice Bulletin. Antiphospholipid syndrome. Number 68; November 2005
- Levine JS, Branch DW, Rauch J. The antiphospholipid syndrome. N Engl J Med 2002;346:752-763. (Level III)
- Derksen RH, Khamshta MA, Branch DW. Management of the obstetric antiphospholipid syndrome. Arthritis Rheum 2004;50:1028-1039. (Level III)
- Ziakas PD. Pavlou M, Voulgarelis M. Heparin treatment in antiphospholipid syndrome with recurrent pregnancy loss. Obstet Gynecol 2010115:1256-1262
- Empson M, Lassere M, Craig JC, Scott JR. Recurrent pregnancy loss with antiphospholipid antibody: a systematic review of therapeutic trials. Obstet Gynecol 2002;99:135-144. (Level III)
- Bates SM, Greer IA, Hirsh J, et al. Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference in Antithrombotic and Thrombolytic Therapy. Chest 2004;126(suppl 3):627S-644S. (Level III)
- Porter TF, Scott JR. Alloimmune causes of recurrent pregnancy loss. Semin Reprod Med 2000;18:341-350
- Rey E, Kahn SR, David M, et al. Thrombophilic disorders and fetal loss: a meta-analysis. Lancet 2003;361:901-908. (Meta-Analysis)
- Lissalde-Lavigne G, Fabbro-Peray P, Cochery-Nouvellon E, et al. Factor V Leiden and prothrombin G20210A polymorphisms as risk factors for miscarriage during a first intended pregnancy: the matched case control 'NOHA first' study. J Thromb Haemost 2005;3:2178-2184. (Level II-2)
- ACOG Practice Bulletin. Inherited thrombophilias in pregnancy. Number 111, April 2010
- Rai R, Regan L. Recurrent miscarriage. Lancet 2006;368:601-605
Publicado: 20 July 2011
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


