Trombofilias hereditarias en el embarazo
WHEC Boletín Práctica Clínica y de gestión para proveedores de atención médica.Educación subvención prevista de Salud de la Mujer y el Centro de Educación (WHEC).
Identificación de las trombofilias hereditarias han aumentado nuestra comprensión de la etiología de un potencial de tromboembolismo venoso (TEV) y de hipercoagulabilidad en general. Algunas mutaciones que contribuyen, como la mutación del factor V de Leiden, la protrombina G20210A mutación, y la metileno tetrahidrofolato reductasa (MTHFR) C677T polimorfismo, son muy comunes en la población general. En los últimos 10 años, algunos estudios han sugerido que la trombofilia hereditaria puede estar asociada con la preeclampsia y otros resultados adversos en el embarazo. Hay pocas pruebas para guiar la detección y el manejo de estas enfermedades en el embarazo. El embarazo tenga éxito es necesario evitar la hemorragia durante la implantación, la remodelación de citotrofoblasto endovascular de las arterias espirales maternas, y durante la tercera etapa del parto, sin embargo, también requiere el mantenimiento de una fluida circulación uteroplacentaria. Mantener el equilibrio hemostático durante el embarazo requiere alteraciones en ambos locales y sistémicas uterinos coagulación, así como proteínas anticoagulantes y fibrinolíticos. Hay una fuerte asociación entre trombofilias hereditarias y tromboembolismo venoso, lo que hace que la detección de estas mutaciones un objetivo lógico para las estrategias de prevención. La trombosis es la hipótesis de ser el mecanismo más común que subyace a la parálisis cerebral en muchos casos de trombofilia materna o fetal, por eso, entender el impacto de la trombofilia materna y fetal en el resultado del embarazo es de suma importancia cuando se aconseja a los pacientes.
El propósito de este documento es revisar las trombofilias comunes y su asociación con el riesgo de tromboembolismo venoso y la madre los resultados adversos del embarazo, las indicaciones para el cribado para la detección de estas condiciones, y opciones de manejo en el embarazo. Es una trombofilia materna y fetal, el trabajo en marcha es necesario en las mujeres que dan a luz a un recién nacido a término con parálisis cerebral? Se necesitan estudios prospectivos para evaluar si ese es el caso. En esta revisión, la literatura sobre el feto trombofilia y su papel en la explicación de algunos casos de derrame cerebral perinatal que conducen, en última instancia, a la parálisis cerebral también se discuten.
Fondo
El embarazo se caracteriza por el aumento potencial de coagulación, disminución de la actividad anticoagulante, y la disminución de la fibrinólisis (1). El potencial trombótica del embarazo se ve agravada por la estasis venosa en las extremidades inferiores debido a la compresión de la vena cava inferior y venas de la pelvis por el útero en crecimiento, un aumento de la hormona mediada en la capacitancia venosa, resistencia a la insulina, y la hiperlipidemia. Por lo tanto, no es sorprendente que la enfermedad tromboembólica venosa complica aproximadamente 1 de cada 1.600 nacimientos y es la principal causa de morbilidad materna en los Estados Unidos (2) . La prevalencia de trombofilias hereditarias comunes es la siguiente:
- Factor V Leiden: Su prevalencia en la población europea es aproximadamente el 5% (3) . A pesar de la mutación está prácticamente ausente en los africanos negro, las poblaciones de Asia en chino, japonés, y otros, está presente en el 3% de los afroamericanos, cuyos antepasados no son inmigrantes recientes. La mutación del factor V hace resistente a la proteólisis por la activación de la proteína C. Las mujeres que son heterocigotos para el factor V Leiden se ha observado que representan aproximadamente el 40% de los casos de tromboembolismo venoso durante el embarazo, sin embargo, el riesgo de tromboembolismo venoso en mujeres embarazadas que son heterocigotos para el factor V de Leiden sin antecedentes personales de tromboembolismo venoso o de primer grado afectado en relación con un episodio de trombosis antes de la edad de 50 años es inferior al 0,3% (4) . Por el contrario, este riesgo aumenta hasta al menos el 10% entre las mujeres embarazadas con antecedentes personales o familiares de tromboembolismo venoso (4) . Las mujeres embarazadas que son homocigotos para el factor V de Leiden sin antecedentes personales de tromboembolismo venoso o de un pariente de primer grado afectado tienen un riesgo del 1-2% para el tromboembolismo venoso, mientras que aquellos con una historia tienen un riesgo un 17%(4).
- Prothrombina G20210A: Se trata de un punto de mutación que da lugar a niveles elevados de protrombina (3) . La protrombina G20210A mutación está presente en aproximadamente el 3% de la población europea, y se ha informado de que representan el 17% de los casos de tromboembolismo venoso durante el embarazo (5) . Al igual que con el factor V Leiden, una historia personal o historia de tromboembolismo venoso en un familiar de primer grado antes de cumplir los 50 años aumenta el riesgo de tromboembolismo venoso durante el embarazo. Sin esa historia, los portadores de la protrombina G20210A mutación tienen un riesgo inferior al 0,5% de tromboembolismo venoso durante el embarazo, porque un vehículo con una historia, el riesgo supera el 10% (5) . Las mujeres embarazadas que son homocigotos para la protrombina G20210A mutación sin antecedentes personales o familiares positivas tienen un riesgo del 2-3% de tromboembolismo venoso durante el embarazo, mientras que una historia tan confiere un riesgo sustancialmente mayor. La combinación del factor V Leiden y la protrombina G20210A mutaciones tiene efectos sinérgicos de hipercoagulabilidad. Aquellos que son heterocigotos para esta combinación, aunque está presente en sólo el 1 por cada 10.000 pacientes, tienen un riesgo del 4-5% de la tromboembolia venosa, incluso sin una historia personal y familiar(4),(5).
- Deficiencia de proteína C: Se ha vinculado a más de 160 mutaciones distintas que producen un fenotipo muy variable (3) . La prevalencia de deficiencia de proteína C es 0.2-0.3% cuando se determina por un ensayo funcional con un punto de corte de 50-60%. El riesgo de tromboembolismo venoso durante el embarazo, entre la proteína C típico paciente deficiente con una historia personal o familiar se ha informado de que 2.7% (6) . Aunque es raro, los recién nacidos homocigotos para la deficiencia de proteína C se desarrollará neonatales púrpura fulminante y requieren anticoagulación de por vida (6).
- Deficiencia de proteína S: Por lo general, tiene dos causas, una de genes silenciados, o una mutación, lo que resulta en los niveles de antígeno de la proteína S libre y la reducción de actividad (3) . La detección de la deficiencia de proteína S utilizando ensayos de actividad solo está sujeta a la variabilidad sustancial debido a la fluctuación de los niveles de proteína de unión a la proteína S en el embarazo (7) . Por lo tanto, la detección en el embarazo es necesario, los valores de corte para los niveles de antígeno de la proteína S libre en el segundo y tercer trimestre se han identificado en menos del 30% y 24% menos que, respectivamente (1) . Entre los que tenían una historia familiar positiva, el riesgo de tromboembolismo venoso durante el embarazo se ha informado que será de 6 a 7% (7) . Al igual que con la deficiencia de proteína C, proteína resulta homocigotos S deficiencia de púrpura fulminante neonatal(6).
- Deficiencia de antitrombina: Es altamente trombogénica, pero poco frecuente, los más de 250 mutaciones asociadas pueden disminuir la transcripción de genes, dando lugar a reducciones tanto en el antígeno y actividad, o alterar la estructura y la función que lleva a niveles de antígeno normal, pero disminución de la actividad (8) . El estado homocigótico muy raro está asociado con la actividad antitrombina poca o ninguna. La prevalencia de deficiencia de antitrombina es de aproximadamente 1 por cada 2.500 pacientes (8) . En pacientes no embarazadas, el riesgo de tromboembolismo venoso entre los pacientes con deficiencia de antitrombina se incrementó más de 25 veces. El embarazo puede aumentar el potencial trombogénico de la deficiencia de antitrombina sustancialmente (8) . Sin embargo, este riesgo puede ser mucho menor en ausencia de una historia positiva familiar o personal.
- Metilentetrahidrofolato reductasa (MTHFR): homocigosis para esta mutación genética es la causa más frecuente de hiperhomocisteinemia. Homocigosis para el polimorfismo MTHFR C677T y A1298C está presente en 10-16% y 4-6% de todos los europeos, respectivamente (9) . Sin embargo, las mutaciones MTHFR por sí solos no parecen transmitir un mayor riesgo de tromboembolismo venoso, ya sea en mujeres no embarazadas o mujeres embarazadas (9) . Aunque la hiperhomocisteinemia se había informado anteriormente a ser un factor de riesgo moderado de tromboembolismo venoso, los datos recientes indican que los niveles elevados de homocisteína son un factor de riesgo débil de la enfermedad tromboembólica venosa (10) . Esta observación puede reflejar la dieta ácido fólico, repleta de los países desarrollados, incluidos los estudios de suplementación de ácido fólico con los suplementos de vitamina B en pacientes no embarazadas no muestran una reducción en el tromboembolismo venoso. Por lo tanto, no hay pruebas suficientes para apoyar la evaluación de los polimorfismos de MTHFR o la medición de los niveles de homocisteína en ayunas en la evaluación de una etiología trombofílica de tromboembolismo venoso, y por lo tanto, no es recomendable.
- Trombofilias Otros: Una variedad de trombofilias otros han descrito, incluyendo mutaciones alternativos en el gen del factor V, una mutación en el gen promotor del PAI-1, la deficiencia de proteína Z, y las mutaciones para mejorar la actividad en varios genes de factores de coagulación. A pesar de que parece que ejercen poco riesgo independiente de enfermedad tromboembólica venosa, que puede agravar el riesgo entre los pacientes con las mutaciones mencionadas. Sin embargo, no hay pruebas suficientes para recomendar el cribado de estas trombofilias.
Trombofilias hereditarias y resultados adversos del embarazo
El papel que trombofilias hereditarias o adquiridas pueden jugar en la patogénesis de la preeclampsia ha sido investigado a fondo por varios años. Los datos de este estudio (11) demuestran que la trombofilia se asocia con un aumento de más de 2,5 veces en el riesgo de recurrencia de la preeclampsia. Los resultados fueron similares en el subgrupo de mujeres con factor V Leiden y factor de mutaciones II, la forma más común de trombofilia hereditaria. La observación de que los pacientes que previamente han tenido preeclampsia tienen un riesgo mayor para el desarrollo posterior de episodios tromboembólicos es mayor la evidencia epidemiológica que une la trombofilia y preeclampsia. Factor V Leiden y la mutación del factor II y trombofilia en sí aumenta el riesgo de recurrencia de la preeclampsia, y las mujeres que tienen un historial de preeclampsia deben ser examinados para trombofilia para identificar a un grupo de alto riesgo de las mujeres que pueden ser elegibles para los ensayos de intervención (11) . Los meta-análisis y un estudio de cohorte retrospectivo han revelado una asociación entre trombofilias hereditarias y en el primer trimestre la pérdida del embarazo (12) . El Eunice Kennedy Shriver Instituto Nacional de Salud Infantil y Desarrollo Humano de Materno-Fetal Red de Unidades de Medicina probado mujeres de bajo riesgo con menos embarazo de feto único de 14 semanas de gestación. La Medicina Materno-Fetal Red de Unidades identificaron a 134 mujeres que fueron heterocigotos para el factor V Leiden, entre 4.885 mujeres embarazadas, y no encontró ningún aumento en la incidencia de pérdida fetal (13) . Hallazgos similares de no aumenta el riesgo de pérdida fetal se caracteriza por las compañías maternos de la protrombina G20210A mutación del gen(13).
Múltiples estudios de revisión de casos y controles, cohortes, y sistemática no han podido detectar una asociación significativa entre el factor V Leiden y la restricción del crecimiento intrauterino (RCIU) menor que el percentil 10 o inferior al percentil 5 (14) . La misma falta de asociación se observó entre la protrombina G20210A mutación y RCIU (14) . En general, no hay pruebas suficientes para establecer un vínculo entre la trombofilia y desprendimiento de la placenta. Los análisis prospectivos de cohortes de factor V de Leiden, la protrombina G20210A , y el resultado del embarazo no encontró ninguna asociación con el desprendimiento de la placenta (15) . El Estudio de homocisteína Hordaland encontrado una asociación entre la hiperhomocisteinemia y el desprendimiento de la placenta más de 15 asociaciones micromol / L, pero mínimo entre la homocigosis para el polimorfismo MTHFR C677T y desprendimiento de la placenta (15).
Consideraciones clínicas
La detección de trombofilia en la polémica. Sólo es útil cuando los resultados afectarán a las decisiones de gestión, y no es útil en situaciones donde el tratamiento está indicado para otros factores de riesgo. La investigación puede ser considerado en las siguientes situaciones clínicas:
- Antecedentes personales de tromboembolismo venoso, que se asoció con factores de riesgo no recurrentes (por ejemplo, fracturas, cirugía, y la inmovilización prolongada). El riesgo de recurrencia entre las mujeres embarazadas tratadas con una historia y una trombofilia fue del 16% (16).
- Un familiar de primer grado (por ejemplo, padres o hermanos) con antecedentes de alto riesgo tromboembolia venosa o trombofilia antes de la edad de 50 años en ausencia de otros factores de riesgo en la medida en que las mujeres afectadas deben recibir profilaxis.
En otras situaciones, las pruebas de trombofilia no se recomienda. Pruebas de trombofilias hereditarias en las mujeres que han sufrido la pérdida fetal recurrente o desprendimiento de la placenta, no se recomienda. Aunque puede haber una asociación en estos casos, no hay suficiente evidencia clínica de que la profilaxis anteparto con heparina no fraccionada o heparina de bajo peso molecular (HBPM) previene la recurrencia en estos pacientes (17) . Sin embargo, la detección de anticuerpos antifosfolípidos pueden ser apropiados en pacientes que experimentan la pérdida del feto. Además, no hay pruebas suficientes de una asociación, y por lo tanto, pruebas suficientes para detectar o tratar a las mujeres con trombofilias hereditarias y las historias obstétricas que incluyen complicaciones como la preeclampsia o IUGR.
Pruebas de laboratorio para trombofilias
Siempre que sea posible, las pruebas de laboratorio se deben realizar a distancia (después de 6 semanas) desde el evento trombótico y mientras el paciente no está embarazada y no tomar anticoagulantes o terapia hormonal.
Las pruebas recomendadas son las siguientes (18):
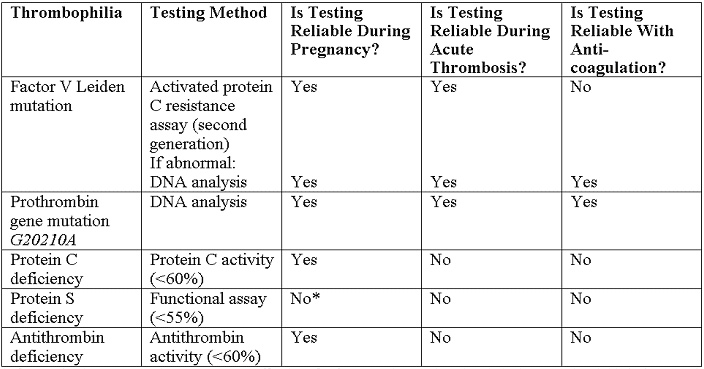
*NOTA - En caso de detección en el embarazo es necesario, los valores de corte para los niveles de antígeno de la proteína S libre en el segundo y tercer trimestre se han identificado en menos del 30% y 24% menos que, respectivamente.
Los regímenes anticoagulantes para mujeres embarazadas
Teniendo en cuenta el riesgo y la relación de beneficio de la heparina no fraccionada, HBPM en general, es el agente preferido para la profilaxis durante el embarazo. Todos los pacientes con trombofilias hereditarias deben ser sometidos a la evaluación del riesgo individual, que puede modificar las decisiones de gestión. La necesidad de ajustar la dosis de HBPM de acuerdo a los niveles de anti-Xa es controvertido. Heparina no fraccionada y Varios regímenes de HBPM se describen a continuación (18):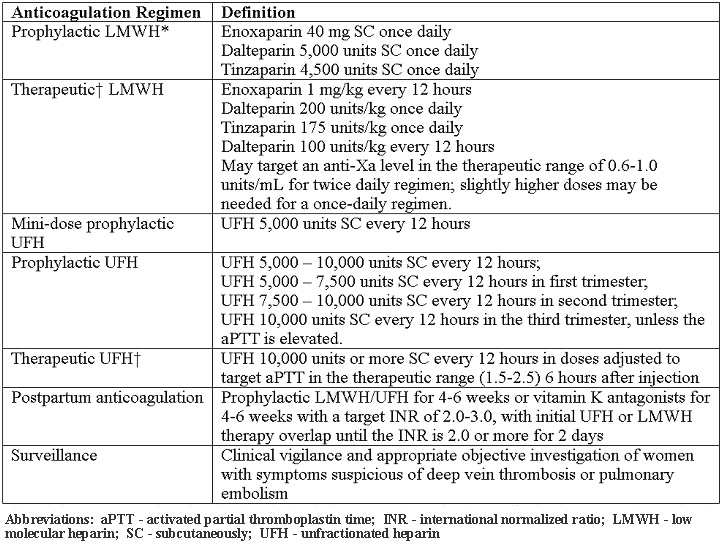
*Aunque en los extremos de peso corporal, la modificación de la dosis puede ser necesario.
†También se conoce como peso ajustado, el tratamiento de dosis completa.
La profilaxis recomendada para embarazos complicados por trombofilias hereditarias:
La decisión de tratar con la profilaxis de la trombosis, el tratamiento anticoagulante, o ningún tratamiento farmacológico (de vigilancia antes del parto) se ve influida por la historia de tromboembolismo venoso, la gravedad de trombofilia heredada, y los factores de riesgo adicionales. Todos los pacientes con trombofilia hereditaria deben someterse a la evaluación del riesgo individual, que puede modificar las decisiones de gestión. La decisión con respecto a la intensidad del tratamiento puede ser determinada por otros factores de riesgo, como parto por cesárea, la inmovilidad prolongada, obesidad y antecedentes familiares de trombofilia o tromboembolismo venoso. Nuestras recomendaciones son:
- De bajo riesgo de trombofilia (factor V de Leiden heterocigoto, la protrombina G20210A heterocigotos, proteína C o la deficiencia de proteína S) de los pacientes sin historia previa de enfermedad tromboembólica venosa (ETV): vigilancia sin anticoagulación profiláctica o HBPM o HNF se recomienda generalmente. En la vigilancia de puerperio sin anticoagulación o terapia anticoagulante después del parto si el paciente tiene otros factores de coagulación (por ejemplo, pariente de primer grado con antecedentes de un episodio trombótico antes de la edad de 50 años, la obesidad, la inmovilidad prolongada).
- Pacientes de bajo riesgo trombofilia con un solo episodio anterior de TEV-no reciben tratamiento a largo plazo la anticoagulación: vigilancia HBPM / HNF o profilácticos o intermedio de la dosis sin anticoagulación se recomienda. En la terapia de anticoagulación puerperio o intermedio de la dosis de HBPM / HNF.
- Alto riesgo de trombofilia (deficiencia de antitrombina, heterocigoto doble para la protrombina G20210A mutación factor V de Leiden y, factor V de Leiden homocigoto o de la protrombina G20210A homocigota mutación) pacientes sin TEV previo: profilaxis con HBPM o HNF y en la terapia anticoagulante después del parto.
- De alto riesgo los pacientes con trombofilia un solo episodio anterior de TEV-no reciben tratamiento a largo plazo la anticoagulación profiláctica:, intermedio de dosis, o ajustadas régimen de dosis de HBPM / HNF, y en la terapia de anticoagulación puerperio o intermedio o ajustada la dosis de HBPM / HNF durante 6 semanas son las recomendaciones habituales. Nivel terapia debe ser al menos tan alta como tratamiento anteparto.
- No trombofilia con un solo episodio previo de tromboembolismo venoso con y sin factores de riesgo asociado (idiopática) - que no reciben terapia a largo plazo la anticoagulación: dosis profiláctica de HBPM o HNF se recomienda en el período anterior al parto y en la terapia de anticoagulación puerperio.
- La trombofilia o no trombofilia con dos o más episodios de TEV - recibir anticoagulación a largo plazo: terapéutica de dosis de HBPM o HNF durante el período anterior al parto se recomienda y en la reanudación del período post parto de la terapia anticoagulante a largo plazo.
Intraparto de gestión de pacientes trombofílicos
El uso de botas de compresión neumática o medias elásticas debe ser considerada para los pacientes con una conocida trombofilia hasta que después del parto ambulatoria. Además, la profilaxis con heparina no fraccionada durante el parto debe ser considerada en pacientes con mayor riesgo. Independientemente de si el paciente está recibiendo dosis profiláctica, intermedios o terapéutica de HBPM, debe considerarse la posibilidad de sustituir una dosis similar de la heparina no fraccionada a las 36 semanas de gestación para permitir la inducción de la anestesia neuroaxial durante el parto (19) . Por otra parte, las dosis ajustadas de HBPM por vía subcutánea o heparina no fraccionada se puede suspender 24-36 horas antes de la inducción o asistencia al parto por cesárea programada para evitar el efecto anticoagulante durante el embarazo. Los pacientes que recibieron anticoagulación profiláctica debe ser instruido para retener sus inyecciones en el inicio del parto. Si el parto vaginal o por cesárea se produce más de 4 horas después de una dosis profiláctica de heparina no fraccionada, el paciente no es un riesgo significativo de complicaciones hemorrágicas. Más allá de 12 horas después de una dosis profiláctica o 24 horas después de una dosis terapéutica de HBPM, la anestesia espinal no se debe impedir que el riesgo de hemorragia relacionada con el procedimiento está limitado (20) . Los pacientes que recibieron heparina no fraccionada o HBPM que requieren rápida reversión del efecto anticoagulante para la entrega puede ser tratada con sulfato de protamina (20) . Además, la antitrombina concentrados se pueden utilizar en anti-trombina pacientes con deficiencia en el período periparto.
Gestión de posparto
Dosis postparto de heparina no fraccionada o HBPM debe ser igual o mayor que la terapia anteparto. La heparina no fraccionada o HBPM se puede reiniciar en 4-6 horas después del parto vaginal o de 6-12 horas después del parto por cesárea. Los pacientes que serán tratados con warfarina puede iniciar el tratamiento inmediatamente después del parto. La dosis inicial de warfarina debe ser de 5 mg al día durante 2 días, con dosis posteriores determinados por el control de la razón normalizada internacional (INR). Para evitar la trombosis paradójica y necrosis de la piel de los efectos antiproteína C a principios de la warfarina, las mujeres deben mantenerse en las dosis terapéuticas de heparina no fraccionada o HBPM durante 5 días y hasta que el INR es terapéutico (2,0 a 3,0) durante 2 días consecutivos. Debido a que la warfarina, HBPM y heparina no fraccionada no se acumulan en la leche materna y no provocar un efecto anticoagulante en el niño, estos anticoagulantes son compatibles con la lactancia materna (21), (22).
El riesgo de TEV en las mujeres que utilizan estrógenos que contienen los anticonceptivos orales aumenta 35 a 99 veces y 16 veces entre las mujeres heterocigotos para el factor V Leiden y la protrombina G20210A, respectivamente (23). El riesgo anual de TEV es de 5,7 por cada 10.000 entre los portadores de factor V Leiden, en comparación con 28,5 por cada 10.000 mujeres que entre los factores V Leiden heterocigotos con anticonceptivos que contienen estrógeno, el riesgo relativo de 34,7 (24). Por lo tanto, los métodos alternativos, tales como los dispositivos intrauterinos (incluyendo los que contienen progestina) y píldoras sólo de progestina o implantes, y los métodos de barrera, debe ser considerado. Sin embargo, el cribado a todas las mujeres de trombofilia antes de iniciar la combinación de anticonceptivos no es recomendable.
Trombofilia fetal, parálisis cerebral perinatal del trazo y
La trombofilia se describe un espectro de trastornos de la coagulación congénitos o adquiridos asociados con la trombosis venosa y arterial. Estos trastornos pueden ocurrir en la madre o en el feto, o en ambos de forma concomitante. Fetal trombofilia tiene una incidencia de 2,4 a 5,1 casos por cada 100.000 nacimientos (25) . Considerando que la trombofilia materna tiene una incidencia más alta posteriormente, tanto la trombofilia materna y fetal puede dar lugar a efectos adversos maternos y fetales. Trombofilia conduce a la trombosis en la interfase materno o fetal. Cuando la trombosis se presenta por el lado materno, la consecuencia puede ser la preeclampsia severa, RCIU, la placenta desprendimiento de placenta, o la pérdida fetal. La trombosis en el lado fetal puede ser una fuente de émbolos que pasar por alto hepática y la circulación pulmonar y viajan al cerebro del feto (25) . Como resultado, el recién nacido puede sostener un evento catastrófico como el accidente cerebrovascular perinatal arterial a través de la trombosis arterial, trombosis del seno venoso cerebral o trombosis de la vena renal.
Derrame cerebral perinatal se define como un accidente cerebrovascular que se produce entre las 28 semanas de gestación y 28 días de edad postnatal (26) . La incidencia es de aproximadamente 17 a 93 casos por cada 100.000 nacidos vivos (26) . derrame cerebral neonatal ocurre en aproximadamente 1 de cada 4.000 nacidos vivos. Además, 1 de cada 2.300 a 4.000 recién nacidos se da un diagnóstico de accidente cerebrovascular isquémico en el vivero (26) . Accidente cerebrovascular isquémico arterial en las cuentas de recién nacidos para un 50% a 70% de los casos de parálisis cerebral hemipléjica congénita. Factor V Leiden, mutación gen de la protrombina, y una deficiencia de proteína C, proteína S, y antitrombina III han tomado conjuntamente en dos estudios, se han identificado en más de 50% de ataques isquémicos cerebrales (27) . Además de estas trombofilias, importantes factores de riesgo para el accidente cerebrovascular perinatal y neonatal son:
- La trombosis en las vellosidades placentarias o buques;
- La infección;
- El uso de un catéter intravascular.
Qué causa el derrame cerebral perinatal?
El mecanismo que subyace en tiempos perinatal es un evento tromboembólico que se origina ya sea un vaso intracraneal o extracraneal, el corazón, o de la placenta (27) . Un reciente meta-análisis encontró una correlación estadísticamente significativa entre la deficiencia de proteína C, MTHFR C677T, y la primera aparición del accidente cerebrovascular isquémico arterial en la población pediátrica (28) . El cerebro es el órgano más grande y más vulnerables del feto susceptibles de trombos que se forman ya sea en la placenta o en otro lugar. La presencia de graves lesiones vasculares fetales se correlaciona altamente con trastornos neurológicos y parálisis cerebral. Un hallazgo patológico, vasculopatía fetal trombótica (FTV), se ha asociado con una lesión cerebral.
La parálisis cerebral es la discapacidad motora crónica más común de la infancia. Aproximadamente 2 a 2,5 de cada 1.000 niños se les da un diagnóstico de este trastorno cada año (29) . La condición aparece temprano en la vida, no es el resultado de una enfermedad reconocida progresiva. Los factores de riesgo de la parálisis cerebral son múltiples y heterogéneos: la prematuridad, la hipoxia y la isquemia, y trombofilia. A pesar de la trombofilia es un factor de riesgo reconocido para la parálisis cerebral, la fuerza de la asociación aún no ha sido investigado a fondo. Lamentablemente para los pacientes y sus descendientes, la evidencia sobre la relación entre la trombofilia y un resultado neurológico adverso es suficientemente fuerte como para ofrecer mucho en el camino de las recomendaciones definitivas para los obstetras. Le sugerimos algunas recomendaciones preliminares sobre la gestión de: someterse a pruebas, cuando la parálisis cerebral se produce en asociación con el ictus perinatal, detección fetal y materna para trombofilia puede ser realizada (27), (30). El panel de trombofilia recomendada comprende las pruebas de:
- El factor V Leiden;
- Protrombina G20210A;
- Anticuerpos anticardiolipina;
- MTHFR mutación.
Cribado familiar también se ha sugerido en los casos de 1) múltiples factores de riesgo protrombóticos en un recién nacido afectado, y 2) una historia familiar positiva. El costo-efectividad del cribado de trombofilia no ha sido evaluada en estudios prospectivos, ya que el valor predictivo positivo del cribado es extremadamente bajo.
Resumen
Trombofilias hereditarias son un grupo heterogéneo de trastornos de la coagulación que predisponen a las personas a los eventos tromboembólicos. Ellos son los principales factores de riesgo de tromboembolismo durante el embarazo y el puerperio. Además, trombofilias se han visto implicados en una variedad de eventos obstétricos adversos, incluyendo la pérdida del embarazo (en especial la muerte del feto), la preeclampsia, desprendimiento de la placenta, y RCIU. La fisiopatología es incierta pero se cree que involucra la trombosis en la circulación útero-placentaria, lo que lleva al infarto y la insuficiencia placentaria. Por lo tanto, la terapia anticoagulante tiene el potencial para mejorar los resultados obstétricos en mujeres con trombofilia hereditaria. Los resultados del embarazo en mujeres asintomáticas con trombofilias hereditarias son a menudo buenas. Por lo tanto, el tratamiento de rutina con la tromboprofilaxis no puede justificarse en estas mujeres. El estudio de trombofilia hereditaria en las mujeres que han sufrido la pérdida fetal recurrente o desprendimiento de la placenta, no se recomienda porque no está claro si la anticoagulación reduce la recurrencia. Debido a la falta de asociación entre la mutación MTHFR y los resultados negativos del embarazo, la detección de los niveles de homocisteína en ayunas o análisis de la mutación MTHFR no es recomendable. La detección de trombofilias hereditarias debe incluir mutación del factor V Leiden, la protrombina G20210A mutación, y la antitrombina, proteína C, proteína S y las deficiencias. Todos los pacientes con trombofilias hereditarias deben ser sometidos a la evaluación del riesgo individual, que puede modificar las decisiones de gestión. Después del parto warfarina, HBPM, y anticoagulación con heparina no fraccionada se puede utilizar en mujeres que amamantan. Una madre cuyo bebé ha recibido un diagnóstico de la trombofilia y el accidente cerebrovascular fetal o neonatal se puede ofrecer la tromboprofilaxis (con heparina y aspirina) durante cualquier embarazo posterior. La utilidad de esta intervención no ha sido bien estudiado y se basa únicamente en la opinión de expertos, sin embargo, por lo que es imprescindible para orientar a los pacientes sobre los riesgos y beneficios de la terapia profiláctica de antemano.
Reconocimiento: La gratitud se expresa que Dr. John R. Higgins, profesor de Obstetricia y Ginecología, Director de la Facultad de Medicina y Salud de la University College de Cork, Cork Hospital de Maternidad de la Universidad, Wilton, Cork, Irlanda para servir como revisor y sugerencias útiles en la elaboración del manuscrito.
Referencias
- Paidas MJ, Ku DH, Lee MJ, et al. Protein Z, protein S levels are lower in patients with thrombophilia and subsequent pregnancy complications. J Thromb Haemost 2005;3:497-501. (Level II-3)
- Chang J, Elam-Evans LD, Berg CJ, et al. Pregnancy-related mortality surveillance – United States, 1991-1999. Morb Mortal Wkly Rep Survell Summ 2003;52:1-8. (Level II-3)
- Franco RF, Reitsma PH. Genetic risk factors of venous thrombosis. Hum Genet 2001;109:369-384. (Level III)
- Zotz RB, Gerhardt A, Scharf RE. Inherited thrombophilia and gestational venous thromboembolism. Best Pract Res Clin Haematol 2003;16:243-259. (Level III)
- Gerhardt A, Scharf RE, Beckman MW, et al. Prothrombin and factor V mutations in women with a history of thrombosis during pregnancy and the puerperium. N Engl J Med 2000;342:374-380. (Level II-3)
- De Stefano V, Leone G, Mastranglo S, et al. Thrombosis during pregnancy and surgery in patients with congenital deficiency of antithrombin III, protein C, protein S. Thromb Haemost 1994;71:799-800. (Level III)
- Goodwin AJ, Rosendaal FR, Kottke-Marchant K, et al. A review of the technical, diagnostic, and epidemiologic considerations for protein S assays. Arch Pathol Lab Med 2002;126:1349-1366. (Level III)
- Carraro P. Guidelines for the laboratory investigation of inherited thrombophilias. Recommendations for the first level clinical laboratories. European Communities Confederation of Clinical Chemistry and Laboratory Medicine. Working Group on Guidelines for Investigation of Disease. Clin Chem Lab Med 2003;41:382-391. (Level III)
- Domagala TB, Adamek L, Nizankowska E, et al. Mutations C677T and A1298C of the 5,10-methylenetetrahydofolate reductase gene and fasting plasma homocysteine levels are not associated with the increased risk of venous thromboembolic disease. Blood Coagul Fibronolysis 2002;13:423-431. (Level II-3)
- de Heijer M, Willems HP, Blom HJ, et al. Homocysteine lowering by B vitamins and the secondary prevention of deep vein thrombosis and pulmonary embolism: A randomized, placebo-controlled, double-blind trial. Blood 2007;109:139-144. (Level I)
- Facchinetti F, Marozio L, Frusca T, et al. Maternal thrombophilia and the risk of recurrence of preeclampsia. Am J Obstet Gynecol 2009;200:46.e1-46.e5
- Lissalde-Lavigne G, Fabbro-Peray P, Cochery-Nouvellon E, et al. Factor V Leiden and prothrombin G20210A polymorphisms as risk factors for miscarriage during a first intended pregnancy: the matched case-control 'NOHA first' study. J Thromb Heamost 2005;3:2178-2184. (Level II-2)
- Silver RM, Zhao Y, Song Y, et al. Prothrombin gene G20210A mutation and obstetric complications. Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal-Fetal Medicine Units (NICHD MFMU) Network. Obstet Gynecol 2010;115:14-20. (Level II)
- Infante-Rivad C, Rivard GE, Yotov WV, et al. Absence of association of thrombophilia polymorphisms with intrauterine growth restriction. N Enlg J Med 2002;347:19-25. (Level II-2)
- Nurk E, Tell GS, Refsum H, Ueland PM, et al. Factor V Leiden, pregnancy complications and adverse outcomes: the Hordaland Homocysteine Study. QJM 2006;99:289-298. (Level II-2)
- Brill-Edwards P, Ginsberg JS, Gent M, et al. Recurrence of clot in This Pregnancy Study Group. Safety of withholding heparin in pregnant women with a history of venous thromboembolism. Recurrence of Clot in This Pregnancy Study Group. N Engl J Med 2000;343:1439-1444. (Level I)
- Kanndorp D, Di Nisio M, Goddijn M, et al. Aspirin or anticoagulants for treating recurrent miscarriage in women without antiphospholipid syndrome. Cochrane Database of Systematic Reviews 2009; Issue 1. Art. No.: CD004734. DOI: 10.1002/14651858.CD004734.pub3. (Level III)
- American College of Obstetricians and Gynecologists. Inherited thrombophilias in pregnancy; practice bulletin No. 124, September 2011. Obstet Gynecol 2011;118:730-740
- Horlocker TT, Wedel DJ, Benzon H, et al. Regional anesthesia in the anticoagulated patient: defining the risks (the second ASRA Consensus Conference on Neuroaxial Anesthesia and Anticoagulation). Reg Anesth Pain Med 2003;28:172-197. (Level III)
- Duhl AJ, Paidas MJ, Ural SH, et al. Antithrombotic therapy and pregnancy: consensus report and recommendations for prevention and treatment of venous thromboembolism and adverse pregnancy outcomes. Pregnancy and Thrombosis Working Group. Am J Obstet Gynecol 2007;197:457.e1-457.e21
- Richter C, Sitzmann J, Lang P, et al. Excretion of low molecular weight heparin in human milk. Br J Clin Pharmacol 2001;52:708-710. (Level III)
- Clark SL, Porter TF, West FG. Coumarin derivatives and breastfeeding. Obstet Gynecol 2000;95:938-940
- Gomes MP, Deitcher SR. Risk of venous thromboembolic disease associated with hormonal contraceptives and hormone replacement therapy: a clinical review. Arch Intern Med 2004;164:1965-1976. (Level III)
- American College of Obstetricians and Gynecologists. Use of hormonal contraception in women with coexisting medical conditions. ACOG Practice Bulletin No. 73. Obstet Gynecol 2006;107:1453-1472. (Level III)
- Lee J, Croen LA, Backstrand KH, et al. Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA 2005;293:723-729
- Nelson KB. Thrombophilias, Thrombosis and Outcome in Pregnancy, Mother, and Child Symposium. Society of Maternal-Fetal Medicine 26th Annual Meeting. Miami Beach, FL; 2006
- Nelson KB, Lynch JK. Stroke in newborn infants. Lancet Neurol 2004;3:150-158
- Winter S, Autry A, Boyle C, et al. Trends in the prevalence of cerebral palsy in a population-based study. Pediatrics 2002;110:1220-1225
- American College of Obstetricians and Gynecologists and American Academy of Pediatrics. Neonatal Encephalopathy and Cerebral Palsy: Defining the Pathogenesis and Pathophysiology. Washington DC: The American College of Obstetricians and Gynecologists; September 2003
- Gibson CS, MacLennan AH, Goldwater PN, et al. Antenatal causes of cerebral palsy: associations between inherited thrombophilias, viral and bacterial infection, and inherited susceptibility to infection. Obstet Gynecol Surv 2003;58:209-220
Publicado: 18 December 2014
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


