Унаследованные тромбофилии у беременных
WHEC Практика бюллетень и клинической Управление медицинских работников.Образовательный грант предоставляется по охране здоровья женщин и образовательный центр (WHEC).
Определение наследственных тромбофилии возросло понимание одного потенциального Этиология венозной тромбоэмболии (ВТЭ) и гиперкоагуляции в целом. Некоторые способствующих мутациям, в том числе фактора V Лейден мутации протромбина G20210A мутации, и метиленового тетрагидрофолата редуктазы (MTHFR) C677T полиморфизмом, довольно часто встречаются в общей популяции. За последние 10 лет, некоторые исследования показали, что наследственная тромбофилия может быть связано с преэклампсией и других неблагоприятных исходов беременности. Существует мало доказательств, чтобы вести скрининг и управление этим условиям во время беременности. Успешная беременность требует избежания кровотечения во время имплантации, эндоваскулярные реконструкции цитотрофобласта материнской артерии спираль, а в третьем периоде родов, но также требует поддержания жидкости маточно-плацентарного кровообращения. Поддержание баланса гемостаза во время беременности требует изменений в местные матки и системными свертывания, а также антикоагулянтов и фибринолитических белков. Существует тесная связь между унаследованной тромбофилии и венозной тромбоэмболии, что делает обнаружение этих мутаций логического мишенью для стратегии профилактики. Тромбоз Предполагается, что более общий механизм, лежащие в основе детского церебрального паралича во многих случаях матери или плода тромбофилии, по этой причине, понимание влияния матери и плода тромбофилии на исход беременности имеет первостепенное значение при консультировании пациентов.
Целью данного документа является рассмотрение общих тромбофилии и их связь с материнской риск венозной тромбоэмболии и неблагоприятными исходами беременности, показания для скрининга для выявления этих условий и вариантов управления во время беременности. Является ли для матери и плода тромбофилии работы до необходимости у женщин, которые рожают срок ребенок с церебральным параличом? Перспективные исследования необходимы, чтобы оценить, является ли это дело. В этом обзоре литературы по плода тромбофилии и его роль в объяснении некоторых случаях перинатального инсульта, которые приводят, в конечном счете, с церебральным параличом, также обсуждаются.
Фон
Беременность отмечена повышенная свертываемость потенциал, снижение антикоагулянтной активности и снижение фибринолиза (1). Тромботические потенциал беременность усугубляет венозный застой в нижних конечностях вследствие сдавления нижней полой вены и вен малого таза в расширяющейся матки, гормон-опосредованного увеличения емкости венозного, резистентность к инсулину, и гиперлипидемии. Таким образом, это не удивительно, что венозная тромбоэмболия осложняет примерно 1 в 1600 рождений и является основной причиной материнской смертности в Соединенных Штатах Америки (2). Распространенность распространенных наследственных тромбофилии является:
- Фактор V Leiden: его распространенность в европейских популяциях составляет примерно 5% (3) . Хотя мутация практически отсутствует в черных африканцев, китайском, японском и других азиатских популяций, оно присутствует в 3% афро-американцев, чьи предки не недавние иммигранты. Мутация оказывает фактор V поддаются протеолиза активированного протеина С женщинами, которые являются гетерозиготные фактора V Leiden, как наблюдали, составляют примерно 40% случаев венозной тромбоэмболии во время беременности, однако, риск развития венозной тромбоэмболии у беременных женщин, которые гетерозиготных фактора V Leiden без личной истории венозной тромбоэмболии или пострадавших первой степени с тромботических эпизодов в возрасте до 50 лет составляет менее 0,3% (4) . С другой стороны, этот риск увеличивается, по крайней мере 10% среди беременных женщин с личной или семейной истории развития венозной тромбоэмболии (4). Беременные женщины, гомозиготные фактора V Leiden без личной истории венозной тромбоэмболии или пострадавших первой степени родства имеют риск 1-2% для венозной тромбоэмболии, а те, с такой историей есть на 17% риска(4).
- Протромбиновое G20210A: Это точка мутации, которая приводит к повышению уровня циркулирующего протромбин (3). Протромбиновое G20210A мутация присутствует в приблизительно 3% населения Европы, и, как сообщается, приходится 17% случаев венозной тромбоэмболии во время беременности (5) . Как фактор V Leiden, личной истории и истории развития венозной тромбоэмболии в первой степени родства в возрасте до 50 лет повышает риск развития венозной тромбоэмболии во время беременности. Без такой истории, носителями протромбинового G20210A мутация есть менее 0,5% риск развития венозной тромбоэмболии во время беременности, потому что носитель с такой историей, риск превышает 10% (5) . Беременные женщины, которые гомозиготных по протромбинового G20210A мутация без личных или положительный семейный анамнез у 2-3% риск развития венозной тромбоэмболии во время беременности, в то время как такая история дает существенно больший риск. Сочетание фактор V Leiden и протромбина G20210A мутаций имеет синергетический эффект гиперкоагуляции. Те, кто гетерозиготных по этой комбинации, хотя в настоящее время только 1 на 10000 пациентов, у 4-5%-ый риск развития венозной тромбоэмболии, даже без личной истории семьи (4),(5).
- Дефицит протеина С: Это было связано с более чем 160 различных мутаций, которые производят сильно варьирует фенотип (3) . Распространенность дефицита протеина С составляет 0,2-0,3%, при определении функциональной пробы с обрезанием 50-60%. Риск венозной тромбоэмболии во время беременности у типичного протеина С недостаточности больным с личной или семейной истории, как сообщается, будет 2-7% (6) . Хотя и редко, гомозиготные для новорожденных дефицит протеина С будет развиваться новорожденных Fulminans пурпура и требуют жизни антикоагулянтов (6).
- Дефицит белка S: Как правило, имеет две причины, замолчать ген, или мутация, которая приводит к снижению свободного антигена белок S уровнях, а также деятельность (3) . Обнаружение дефицит белка S с помощью анализов деятельности только подлежит существенной изменчивости в связи с колебаниями уровня белка белка S во время беременности (7) . Таким образом, скрининг во время беременности необходимо, отрезные значения для свободного антигена белок S уровней во втором и третьем триместрах беременности были выявлены менее чем на 30% и менее 24%, соответственно (1) . Среди тех, кто в семейном анамнезе, риск развития венозной тромбоэмболии во время беременности было сообщено, что 6-7% (7) . Как и дефицит протеина С, дефицит белка S гомозиготных результаты у новорожденных пурпура Fulminans(6).
- Дефицит антитромбина: Очень тромбогенного но редко, более 250 связанных мутации могут уменьшить транскрипции генов, что приводит к снижению как антиген и деятельности, или изменить структуру и функции, ведущих к нормальным уровням антиген, но снижение активности (8) . Очень редко гомозиготной состояние связано с практически никакой активности антитромбина. Распространенность дефицита антитромбина составляет примерно 1 на 2500 пациентов (8) . У небеременных пациентов, риск развития венозной тромбоэмболии среди антитромбина-дефицитных пациентов увеличилось более чем в 25 раз. Беременность может увеличить тромбогенного потенциал дефицит антитромбина существенно (8). Тем не менее, этот риск может быть значительно ниже, при отсутствии положительного личной или семейной истории.
- Метилентетрагидрофолатредуктазы (MTHFR): Гомозиготы для этой мутации гена является наиболее распространенной причиной гипергомоцистеинемии. Гомозиготности MTHFR C677T и A1298C полиморфизм присутствует в 10-16% и 4-6% всех европейцев, соответственно, (9) . Тем не менее, мутации MTHFR сами по себе не появляются передать повышенный риск венозной тромбоэмболии в любом небеременных и беременных женщин (9) . Хотя гипергомоцистеинемии Ранее сообщалось, что скромный фактор риска развития венозной тромбоэмболии, последние данные показывают, что повышенные уровни гомоцистеина являются слабым фактором риска развития венозной тромбоэмболии (10). Это наблюдение может отражать фолиевой кислоты, изобилует рационе развитых стран, в том числе фолиевой кислоты исследования добавки с витамином В добавок у небеременных пациентов не показывают снижение в венозной тромбоэмболии. Таким образом, нет достаточных доказательств в поддержку оценки полиморфизмов MTHFR или измерение поста уровня гомоцистеина при оценке этиологии тромбофилии для венозной тромбоэмболии, и поэтому его не рекомендуется.
- Другие тромбофилии: множество других тромбофилии были описаны, в том числе альтернативных мутации в гене фактора V, промоутер мутации в ген ИАП-1, белок Z дефицита и повышению активности в различных мутаций гена фактора свертывания крови. Хотя они, кажется, оказывают мало независимых риск венозной тромбоэмболии, они могут усугубить риск у пациентов с указанными мутациями. Тем не менее, есть достаточно доказательств, чтобы рекомендовать обследование на эти тромбофилии.
Унаследованные тромбофилии и неблагоприятными исходами беременности
Роль, которую наследственные или приобретенные тромбофилии может играть в патогенезе преэклампсии был тщательно исследован в течение нескольких лет. Данные этого исследования (11) показывают, что тромбофилия ассоциируется с более чем 2,5-кратное увеличение риска рецидива гестоза. Результаты были аналогичными в подгруппе женщин с фактор V Лейден и фактора II мутаций, наиболее распространенной формой наследственной тромбофилии. Наблюдение, что у пациентов, которые ранее были преэклампсии, подвергаются повышенному риску для дальнейшего развития тромбоэмболических эпизодов является еще одним свидетельством эпидемиологической связи тромбофилии и преэклампсии. Фактор V Лейден и фактора II мутаций и тромбофилии себе увеличивает риск рецидива гестоза, а также женщины, которые имеют историю преэклампсии должны быть обследованы на тромбофилии выявить группу высокого риска женщин, которые могут иметь право на вмешательство испытания (10) . Мета-анализ и ретроспективного когортного исследования выявили связь между унаследованной тромбофилии и в первом триместре беременности потери (11) . Юнис Кеннеди Шрайвер Национального института здоровья ребенка и матери и плода человека Развития медицины единиц сети протестированы с низким уровнем риска женщин с одноплодной беременности менее 14 недель беременности. Матери и плода медицины единиц сети определены 134 женщин, которые были гетерозиготные фактора V Leiden среди 4885 беременных женщин, и не обнаружили увеличение числа случаев потери плода (13) . Подобные результаты не увеличился риск потери плода было отмечено материнской носителей протромбинового G20210A мутация гена (13).
Несколько случай-контроль, когорты, и систематический обзор исследований не удалось обнаружить значительной связи между фактор V Leiden и внутриутробного развития плода (ЗВРП) меньше, чем 10 процентиль или менее 5-го процентиля (14) . Аналогичное отсутствие связи было отмечено, между протромбинового G20210A мутации и ЗВУР (14) . В целом, есть достаточно доказательств, чтобы установить связь между тромбофилией и отслойка плаценты. Перспективные анализ когорты фактора V Leiden, протромбин G20210A, и исход беременности не обнаружили связи с отслойка плаценты (15). Исследование Hordaland гомоцистеина обнаружили связь между отслойка плаценты и гипергомоцистеинемии более 15 мкмоль / л, а минимальное связь между гомозиготности C677T полиморфизмом MTHFR и отслойка плаценты (15).
Клинические соображения
Скрининг на тромбофилии в спорной. Это полезно только тогда, когда результаты будут влиять на управленческие решения, а также не является полезным в ситуации, когда лечение показано на другие факторы риска. Обследование может быть рассмотрен в следующих клинических условиях:
- Личная история развития венозной тромбоэмболии, которая была связана с единовременным фактором риска (например, переломы, операции и длительной иммобилизации). Риск повторения среди необработанных беременных женщин с такой историей и тромбофилии составила 16% (16).
- Первой степени родства (например, родителей или братьев и сестер), с историей, с высокой степенью риска тромбофилии или венозной тромбоэмболии в возрасте до 50 лет при отсутствии других факторов риска в той мере, пострадавшие женщины должны получать профилактику.
В других ситуациях, тромбофилия тестирование обычно не рекомендуется. Тестирование унаследовал тромбофилии у женщин, которые испытали повторные выкидыши или отслойки плаценты не рекомендуется. Хотя может быть объединение в этих случаях недостаточно клинических доказательств того, что до родов профилактика НФГ или низкомолекулярных гепаринов (НМГ) предотвращает рецидив у этих пациентов (17) . Тем не менее, обследование на антифосфолипидных антител может быть целесообразно у пациентов испытывают потери плода. Кроме того, нет достаточных доказательств, ассоциации, и, следовательно, недостаточно доказательств либо экран и лечения женщин с наследственной тромбофилии и акушерской истории, которые включают такие осложнения, как ЗВУР или преэклампсии..
Испытательная лаборатория для тромбофилии
Когда это возможно, лабораторные испытания должны проводиться удаленный (через 6 недель) от тромботических событий и в то время как пациент не беременна и не принимают антикоагулянты или гормональной терапии.
Рекомендуемые испытания перечислены ниже (18):
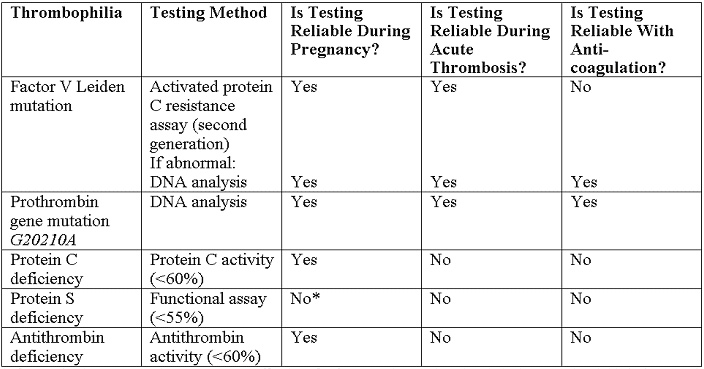
*Примечание - Если обследование во время беременности необходимо, отрезные значения для свободного антигена белок S уровней во втором и третьем триместрах беременности были выявлены менее чем на 30% и менее 24%, соответственно.
Антикоагулянтная схемы для беременных женщин
С учетом рисков и выгод от НФГ, НМГ в целом является предпочтительным агент для профилактики во время беременности. Все пациенты с наследственной тромбофилии должны пройти индивидуальную оценку риска, который может изменить управленческие решения. Необходимость корректировки дозы НМГ по анти-Ха уровней, является спорным. Различные НФГ и НМГ режимы описаны ниже (18):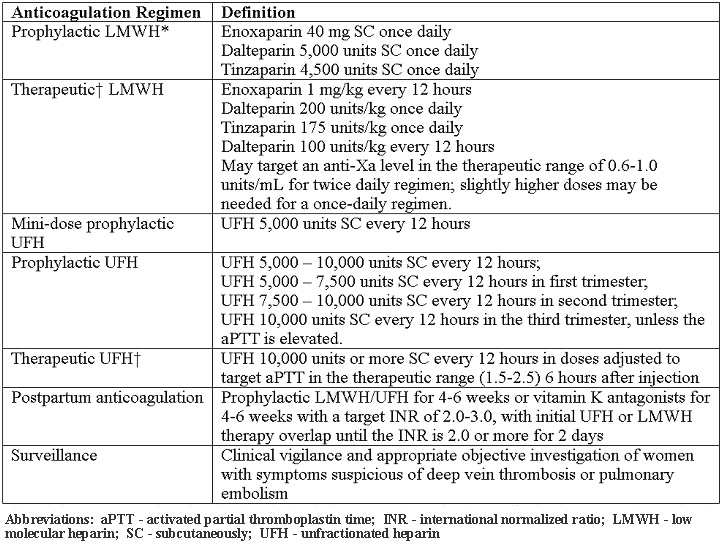
*Несмотря на экстремальные массы тела, изменение дозы может потребоваться
†Также называется вес регулируется, полная доза препарата
Рекомендуемые Тромбопрофилактика для беременностью, осложненной унаследованные тромбофилии:
Решение о лечении с тромбозов, антикоагулянтная терапия, или нет фармакологического лечения (дородовое наблюдение) зависит от истории венозной тромбоэмболии, тяжесть наследственная тромбофилия, и дополнительные факторы риска. Все пациенты с наследственной тромбофилии должны пройти индивидуальную оценку риска, который может изменить управленческие решения. Решение о интенсивности лечения могут быть сформированы и другие факторы риска, такие как кесарево сечение, длительная неподвижность, ожирение и семейной истории тромбофилии или венозной тромбоэмболии. Наши рекомендации:
- Низкого риска тромбофилии (фактор V Leiden гетерозиготной; протромбин G20210A гетерозиготных, протеина С или недостаток белка S) у пациентов без предшествующей истории развития венозной тромбоэмболии (ВТЭ): наблюдение без антикоагулянтной терапии или профилактического НМГ или НФГ рекомендуется. В послеродовой период наблюдения без антикоагулянтной терапии или терапии послеродовых антикоагулянтов, если пациент имеет дополнительные факторы свертывания крови (например, родственник первой степени с историей тромботических эпизодов в возрасте до 50 лет, ожирение, длительная неподвижность).
- Низкого риска тромбофилии у пациентов с одним предыдущим эпизодом ВТЭ - не получение долгосрочных антикоагулянтная терапия: профилактика или промежуточных доз НМГ / НФГ или наблюдения без антикоагулянтной терапии рекомендуется. В послеродовом периоде терапии антикоагулянтами или средней дозы НМГ / НФГ.
- Высокого риска тромбофилии (дефицит антитромбина, дважды гетерозиготных протромбинового G20210A мутации и фактор V Leiden, фактор V Leiden гомозиготной или протромбиновое G20210A мутации гомозиготных) пациентов без предварительного ВТЭ: профилактика НМГ или НФГ и в антикоагулянтной терапии после родов.
- Высокого риска тромбофилии у пациентов с одним предыдущим эпизодом ВТЭ - не получение долгосрочных антикоагулянтной терапии: профилактические, средней дозы, или скорректированная доза НМГ / НФГ режим, и в послеродовом периоде терапии антикоагулянтами или промежуточных или скорректированных доз НМГ / НФГ в течение 6 недель обычно рекомендации. Терапия должна быть на уровне по крайней мере, выше, чем лечение до родов.
- Нет тромбофилии с предыдущим эпизодом ВТЭ и связанные с ними без факторов риска (идиопатический) - не получение долгосрочных антикоагулянтной терапии: профилактические дозы НМГ или НФГ рекомендуется в дородовом периоде и в послеродовой период антикоагулянтной терапии.
- Тромбофилия или нет тромбофилии с двумя или более эпизодов ВТЭ - получение долгосрочных антикоагулянты: терапевтические дозы НМГ или НФГ в течение периода до родов рекомендуется и в послеродовой период возобновления долгосрочного антикоагулянтной терапии.
Родах Управление тромбофилии пациентов
Использование пневматической компрессии ботинки или эластичные чулки должны быть рассмотрены для пациентов с известной тромбофилия, пока они не амбулаторных родов. Кроме того, родов профилактика НФГ должна рассматриваться у пациентов с высоким риском. Независимо от того, пациент получает профилактическое, средней или терапевтические дозы НМГ, следует рассмотреть вопрос о замене в сопоставимых дозы гепарина в 36 недель беременности, чтобы разрешить индукции нейроаксиальной анестезии во время родов (19) . Кроме того, скорректированный дозы подкожного НМГ или НФГ может быть прекращено до 24-36 часов индукция родов или запланированного кесарева сечения, чтобы избежать антикоагулянтный эффект во время беременности. Пациенты, получающие профилактические антикоагулянтов должны быть проинструктированы удержать их инъекции в начале работы. Если вагинальный или кесарева сечения встречается более чем через 4 часа после профилактической дозы гепарина, пациент не значительный риск геморрагических осложнений. За 12 часов после профилактической дозы или 24 часов после терапевтической дозы НМГ, спинальная анестезия не должно быть отказано, потому что риск процедуры, связанные кровотечение ограничено (20) . У пациентов, получавших НФГ и НМГ, которые требуют быстрого разворота антикоагулянтного эффекта для доставки можно лечить с помощью протамина сульфата (20) . Кроме того, антитромбин концентратов могут быть использованы в борьбе с тромбином пациентов с дефицитом в peripartum период.
Послеродовая управления
Послеродовая доз НФГ или НМГ должна быть равной или большей, чем лечение до родов. Нефракционированный гепарин или НМГ может быть возобновлено в течение 4-6 часов после родов через естественные родовые или 6-12 часов после кесарева сечения. Пациенты, которые будут рассматриваться с варфарином может начать лечение сразу после родов. Начальная доза варфарина должно быть 5 мг ежедневно в течение 2 дней, последующие дозы определяются путем наблюдения за международное нормализованное отношение (МНО). Чтобы избежать парадоксальных тромбоз и некроз кожи с начала эффект C antiprotein варфарина, женщины должны быть сохранены на терапевтические дозы гепарина или НМГ в течение 5 дней и до МНО терапевтического (2,0-3,0) в течение 2 дней подряд. Поскольку варфарин, НМГ и НФГ не накапливаются в грудном молоке и не вызывают антикоагулянтный эффект у младенца, это антикоагулянтов, совместимые с грудным вскармливанием (21), (22).
Риск ВТЭ у женщин, использующих эстроген-содержащие пероральные контрацептивы увеличивается 35-99-раз и 16 раз у женщин гетерозиготных фактора V Leiden и протромбина G20210A мутации, соответственно (23) . Ежегодный риск развития ВТЭ составляет 5,7 на 10000 среди фактора V Leiden носителей, по сравнению с 28,5 на 10000 среди фактор V Leiden женщины гетерозиготные использование эстроген-содержащие контрацептивы, относительный риск 34,7 (24) . Таким образом, альтернативные методы, такие, как внутриматочная спираль (в том числе содержащих прогестин), прогестин только таблетки или имплантаты, и барьерные методы, должны быть рассмотрены. Тем не менее, скрининг всех женщин тромбофилии перед началом комбинации контрацепции не рекомендуется.
Плод тромбофилия, перинатальный инсульт и церебрального паралича
Тромбофилия описывает спектр врожденные или приобретенные нарушения свертывания крови связаны с венозной и артериальной тромбоза. Эти расстройства могут возникнуть у матери или плода, или в обоих одновременно. Плод тромбофилия есть заболеваемость 2,4 до 5,1 случаев на каждые 100000 родов (25) . В то время как материнская тромбофилия имеет впоследствии более высокий уровень, как для матери и плода тромбофилии может привести к неблагоприятным для матери и плода событий. Тромбофилия приводит к тромбозу на матери или плода интерфейс. При тромбозе происходит по материнской линии, может быть следствием тяжелой преэклампсией, ЗВУР, отслойка плаценты, или гибель плода. Тромбоз на стороне плода может быть источником эмболии в обход печени и малом круге кровообращения и путешествия в мозг плода (25) . В результате новорожденный может выдержать катастрофические события, такие как перинатальный артериального инсульта через артериальный тромбоз, церебральный тромбоз венозного синуса, почечной или тромбоза вен.
Перинатальная инсульта определяется как цереброваскулярные события, которое происходит в период с 28 недель беременности и 28 дней послеродового возраста (26) . Заболеваемость составляет примерно 17 до 93 случаев на каждые 100000 живорожденных (26) . новорожденных инсульт встречается примерно у 1 из каждых 4000 новорожденных. Кроме того, 1 из каждых 2300 до 4000 новорожденных был поставлен диагноз ишемического инсульта в детской (26) . Артериальная ишемического инсульта у новорожденных составляет от 50% до 70% случаев врожденных гемиплегической церебральным параличом. Фактор V Лейден мутации, протромбин генных мутаций, а также дефицит протеина С, протеина S, антитромбина III и приняли вместе в двух исследованиях, были выявлены в более чем 50% от церебрального ишемического инсульта (27). В дополнение к этим тромбофилии, важные факторы риска перинатальной и неонатальной инсульта включают:
- Тромбоз в ворсин или суда;
- Инфекции;
- Использование внутрисосудистых катетеров.
Что является причиной перинатальной инсульта?
Механизм, лежащий в основе перинатальный инсульт тромбоэмболических случае, если происходит либо внутричерепное или экстракраниальных сосудов, сердца, или плаценты (27). Недавно проведенный мета-анализ показал статистически значимая корреляция между дефицитом протеина С, MTHFR C677T, и первое появление артериальной ишемического инсульта в педиатрической популяции (28) . Мозг является крупнейшим и наиболее уязвимых плода орган подвержен тромбов, которые могут быть оформлены, в плаценте или в другом месте. Наличие тяжелых сосудистых поражений плода коррелирует с высокой неврологические нарушения и детский церебральный паралич. Патологическое открытие, плода тромботические заболевания сосудов (FTV), была связана с повреждением головного мозга.
Церебральный паралич является наиболее распространенной хронической инвалидности двигатель детства. Около 2 до 2,5 на 1000 детей данного диагноза этого заболевания каждый год (29) . Состояние появляется в раннем возрасте, это не результат признан прогрессирующее заболевание. Факторы риска детского церебрального паралича и несколько гетерогенных: преждевременные роды, гипоксия и ишемия, и тромбофилии. Несмотря на то, тромбофилия является признанным фактором риска развития детского церебрального паралича, сила ассоциации до сих пор не полностью изучены. К сожалению для пациентов и их потомки, свидетельствует о связи между тромбофилией и неблагоприятного исхода неврологического недостаточно сильны, чтобы предложить многое на пути окончательной рекомендации для акушеров-гинекологов. Мы предлагаем некоторые предварительные рекомендации по управлению: рассмотреть скрининга, когда церебральный паралич возникает в связи с перинатальный инсульт, матери и плода скрининга тромбофилии может быть выполнено (27), (30). Рекомендуемая тромбофилии панель включает в себя тесты на:
- Фактор V Лейден;
- Протромбиновое G20210A ;
- Антикардиолипиновые антител;
- MTHFR мутации.
Семья отбора также было предложено в случаях: 1) несколько протромботическое факторов риска в пострадавших новорожденных, и 2) положительный семейный анамнез. Экономическая эффективность скрининга тромбофилии не было оценено в перспективные исследования, так как положительная прогностическая ценность такого обследования является крайне низким.
Резюме
Унаследованные тромбофилии являются гетерогенной группой нарушения свертывания крови, что предрасполагает лиц тромбоэмболии. Они являются основными факторами риска тромбоэмболии во время беременности и в послеродовом периоде. Кроме того, тромбофилии были вовлечены в различные побочные эффекты акушерский, в том числе потери беременности (особенно гибель плода), преэклампсия, отслойка плаценты, и ЗВУР. Патофизиологии является неопределенным, но, как полагают, связаны с тромбозом в маточно-плацентарного кровообращения, ведущие к инфаркту и плацентарной недостаточности. Таким образом, антикоагулянтная терапия имеет потенциал для улучшения акушерской результат у женщин с наследственной тромбофилии. Беременность результаты у бессимптомных женщин с наследственной тромбофилии часто являются хорошими. Таким образом, обычное лечение тромбозов, не может быть оправдано в этих женщинах. Наследственная тромбофилия тестирования у женщин, которые испытали повторные выкидыши или отслойки плаценты не рекомендуется, поскольку неясно, является ли антикоагулянтов снижает рецидив. Из-за отсутствия связи между мутацией MTHFR и негативные последствия беременности, обследование с поста уровни гомоцистеина и анализа мутаций MTHFR не рекомендуется. Скрининг на унаследовал тромбофилии должно включать лейденской мутации фактора V.; протромбин G20210A мутации и антитромбина, протеина С и недостатки белка S. Все пациенты с наследственной тромбофилии должны пройти индивидуальную оценку риска, который может изменить управленческие решения. Послеродовая варфарин, НМГ и нефракционированного гепарина, антикоагулянтов может быть использован у женщин, которые кормят грудью. Матери, ребенок получил диагноз тромбофилия и плода или новорожденного инсульта могут быть предложены тромбозов (гепарином и аспирином) во время последующей беременности. Полезность такого вмешательства не было хорошо изучено и основывается исключительно на мнении экспертов, поэтому крайне важно, чтобы консультировать пациентов о рисках и преимуществах профилактической терапии заранее.
Благодарность: благодарность выражается Dr. John R. Higgins, профессор акушерства и гинекологии, руководитель колледжа медицины и здравоохранения, Университетский колледж Корк, Корк университета родильный дом, Уилтон, Корк, Ирландия работу в качестве рецензента и полезные советы при подготовке рукописи.
Ссылки
- Paidas MJ, Ku DH, Lee MJ, et al. Protein Z, protein S levels are lower in patients with thrombophilia and subsequent pregnancy complications. J Thromb Haemost 2005;3:497-501. (Level II-3)
- Chang J, Elam-Evans LD, Berg CJ, et al. Pregnancy-related mortality surveillance – United States, 1991-1999. Morb Mortal Wkly Rep Survell Summ 2003;52:1-8. (Level II-3)
- Franco RF, Reitsma PH. Genetic risk factors of venous thrombosis. Hum Genet 2001;109:369-384. (Level III)
- Zotz RB, Gerhardt A, Scharf RE. Inherited thrombophilia and gestational venous thromboembolism. Best Pract Res Clin Haematol 2003;16:243-259. (Level III)
- Gerhardt A, Scharf RE, Beckman MW, et al. Prothrombin and factor V mutations in women with a history of thrombosis during pregnancy and the puerperium. N Engl J Med 2000;342:374-380. (Level II-3)
- De Stefano V, Leone G, Mastranglo S, et al. Thrombosis during pregnancy and surgery in patients with congenital deficiency of antithrombin III, protein C, protein S. Thromb Haemost 1994;71:799-800. (Level III)
- Goodwin AJ, Rosendaal FR, Kottke-Marchant K, et al. A review of the technical, diagnostic, and epidemiologic considerations for protein S assays. Arch Pathol Lab Med 2002;126:1349-1366. (Level III)
- Carraro P. Guidelines for the laboratory investigation of inherited thrombophilias. Recommendations for the first level clinical laboratories. European Communities Confederation of Clinical Chemistry and Laboratory Medicine. Working Group on Guidelines for Investigation of Disease. Clin Chem Lab Med 2003;41:382-391. (Level III)
- Domagala TB, Adamek L, Nizankowska E, et al. Mutations C677T and A1298C of the 5,10-methylenetetrahydofolate reductase gene and fasting plasma homocysteine levels are not associated with the increased risk of venous thromboembolic disease. Blood Coagul Fibronolysis 2002;13:423-431. (Level II-3)
- de Heijer M, Willems HP, Blom HJ, et al. Homocysteine lowering by B vitamins and the secondary prevention of deep vein thrombosis and pulmonary embolism: A randomized, placebo-controlled, double-blind trial. Blood 2007;109:139-144. (Level I)
- Facchinetti F, Marozio L, Frusca T, et al. Maternal thrombophilia and the risk of recurrence of preeclampsia. Am J Obstet Gynecol 2009;200:46.e1-46.e5
- Lissalde-Lavigne G, Fabbro-Peray P, Cochery-Nouvellon E, et al. Factor V Leiden and prothrombin G20210A polymorphisms as risk factors for miscarriage during a first intended pregnancy: the matched case-control 'NOHA first' study. J Thromb Heamost 2005;3:2178-2184. (Level II-2)
- Silver RM, Zhao Y, Song Y, et al. Prothrombin gene G20210A mutation and obstetric complications. Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal-Fetal Medicine Units (NICHD MFMU) Network. Obstet Gynecol 2010;115:14-20. (Level II)
- Infante-Rivad C, Rivard GE, Yotov WV, et al. Absence of association of thrombophilia polymorphisms with intrauterine growth restriction. N Enlg J Med 2002;347:19-25. (Level II-2)
- Nurk E, Tell GS, Refsum H, Ueland PM, et al. Factor V Leiden, pregnancy complications and adverse outcomes: the Hordaland Homocysteine Study. QJM 2006;99:289-298. (Level II-2)
- Brill-Edwards P, Ginsberg JS, Gent M, et al. Recurrence of clot in This Pregnancy Study Group. Safety of withholding heparin in pregnant women with a history of venous thromboembolism. Recurrence of Clot in This Pregnancy Study Group. N Engl J Med 2000;343:1439-1444. (Level I)
- Kanndorp D, Di Nisio M, Goddijn M, et al. Aspirin or anticoagulants for treating recurrent miscarriage in women without antiphospholipid syndrome. Cochrane Database of Systematic Reviews 2009; Issue 1. Art. No.: CD004734. DOI: 10.1002/14651858.CD004734.pub3. (Level III)
- American College of Obstetricians and Gynecologists. Inherited thrombophilias in pregnancy; practice bulletin No. 124, September 2011. Obstet Gynecol 2011;118:730-740
- Horlocker TT, Wedel DJ, Benzon H, et al. Regional anesthesia in the anticoagulated patient: defining the risks (the second ASRA Consensus Conference on Neuroaxial Anesthesia and Anticoagulation). Reg Anesth Pain Med 2003;28:172-197. (Level III)
- Duhl AJ, Paidas MJ, Ural SH, et al. Antithrombotic therapy and pregnancy: consensus report and recommendations for prevention and treatment of venous thromboembolism and adverse pregnancy outcomes. Pregnancy and Thrombosis Working Group. Am J Obstet Gynecol 2007;197:457.e1-457.e21
- Richter C, Sitzmann J, Lang P, et al. Excretion of low molecular weight heparin in human milk. Br J Clin Pharmacol 2001;52:708-710. (Level III)
- Clark SL, Porter TF, West FG. Coumarin derivatives and breastfeeding. Obstet Gynecol 2000;95:938-940
- Gomes MP, Deitcher SR. Risk of venous thromboembolic disease associated with hormonal contraceptives and hormone replacement therapy: a clinical review. Arch Intern Med 2004;164:1965-1976. (Level III)
- American College of Obstetricians and Gynecologists. Use of hormonal contraception in women with coexisting medical conditions. ACOG Practice Bulletin No. 73. Obstet Gynecol 2006;107:1453-1472. (Level III)
- Lee J, Croen LA, Backstrand KH, et al. Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA 2005;293:723-729
- Nelson KB. Thrombophilias, Thrombosis and Outcome in Pregnancy, Mother, and Child Symposium. Society of Maternal-Fetal Medicine 26th Annual Meeting. Miami Beach, FL; 2006
- Nelson KB, Lynch JK. Stroke in newborn infants. Lancet Neurol 2004;3:150-158
- Winter S, Autry A, Boyle C, et al. Trends in the prevalence of cerebral palsy in a population-based study. Pediatrics 2002;110:1220-1225
- American College of Obstetricians and Gynecologists and American Academy of Pediatrics. Neonatal Encephalopathy and Cerebral Palsy: Defining the Pathogenesis and Pathophysiology. Washington DC: The American College of Obstetricians and Gynecologists; September 2003
- Gibson CS, MacLennan AH, Goldwater PN, et al. Antenatal causes of cerebral palsy: associations between inherited thrombophilias, viral and bacterial infection, and inherited susceptibility to infection. Obstet Gynecol Surv 2003;58:209-220
Опубликован: 4 June 2012
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


