Thrombophilies héréditaires de la grossesse
Bulletin WHEC pratique et de directives cliniques de gestion pour les fournisseurs de soins de santé. Subvention à l'éducation fournie par la santé des femmes et de l'Education Center (WHEC).
Identification des thrombophilies héréditaires a augmenté notre compréhension d'un étiologie potentiel de thromboembolie veineuse (TEV) et de l'hypercoagulabilité en général. Certaines mutations qui contribuent, y compris la mutation facteur V Leiden, mutation G20210A de la prothrombine, et la méthylène tétrahydrofolate réductase C677T polymorphisme (MTHFR), sont très courants dans la population générale. Au cours des 10 dernières années, certaines études ont suggéré que thrombophilie héréditaire peut être associée à la pré-éclampsie et d'autres effets indésirables de la grossesse. Il ya peu de preuves pour guider le dépistage et la gestion de ces pathologies pendant la grossesse. La grossesse réussie, il faut éviter d'hémorragie lors de l'implantation, le remodelage cytotrophoblaste endovasculaire des artères spiralées maternelles, et au cours de la troisième phase du travail, mais exige également le maintien d'une circulation de fluide utéroplacentaire. Maintien de l'équilibre hémostatique pendant la grossesse exige des modifications dans les deux locaux de l'utérus et systémique de la coagulation, ainsi que des protéines anticoagulantes et fibrinolytiques. Il ya une forte association entre thrombophilies héréditaires et la maladie thromboembolique veineuse, ce qui rend la détection de ces mutations d'une cible logique pour des stratégies de prévention. La thrombose est supposée être le mécanisme le plus commun sous-jacent de paralysie cérébrale dans de nombreux cas de thrombophilie maternelle ou foetale; pour cette raison, la compréhension de l'impact de la maternelle et ftale thrombophilie sur la grossesse est d'une importance primordiale lors du counseling des patients.
Le but de ce document est d'examiner thrombophilies communes et leur association avec le risque thrombo-embolie veineuse maternelle et les résultats défavorables de la grossesse, les indications pour le dépistage pour détecter ces conditions, et les options de gestion de la grossesse. Est-ce qu'un maternelle et ftale thrombophilie travail jusqu'à nécessaire chez les femmes qui donnent naissance à un nourrisson né à terme avec la paralysie cérébrale? Des études prospectives sont nécessaires pour évaluer si tel est le cas. Dans cette revue, la littérature sur les ftus thrombophilie et son rôle dans l'explication de certains cas d'AVC périnatal que le plomb, en fin de compte, à la paralysie cérébrale sont également discutés.
fond
La grossesse est marquée par la coagulation accrue, une diminution de l'activité anticoagulante, et une diminution de la fibrinolyse (1). Le potentiel thrombotique de la grossesse est exacerbée par la stase veineuse des membres inférieurs dues à la compression de la veine cave inférieure et des veines pelviennes par l'utérus qui s'élargit, une augmentation de l'hormone de médiation dans la capacitance veineuse, résistance à l'insuline, et l'hyperlipidémie. Ainsi, il n'est pas surprenant que la maladie thromboembolique veineuse complique environ 1 1.600 naissances et est une cause majeure de morbidité maternelle dans les Etats-Unis (2). Prévalence de communes thrombophilies héréditaires est la suivante:
- Facteur V Leiden:Sa prévalence dans les populations européennes est d'environ 5% (3). Bien que la mutation est pratiquement absente chez les Africains noirs, chinois, japonais, et d'autres populations asiatiques, il est présent dans 3% des Afro-Américains dont les ancêtres ne sont pas des immigrants récents. La mutation du facteur V rend réfractaire à la protéolyse par les femmes activés C. protéines qui sont hétérozygotes pour le facteur V de Leiden ont été observées sur le compte pour environ 40% des cas de thrombo-embolie veineuse pendant la grossesse, mais le risque de thromboembolie veineuse chez les femmes enceintes qui sont hétérozygotes pour le facteur V Leiden, sans antécédents personnels de maladie thromboembolique veineuse ou un touché au premier degré avec un épisode thrombotique avant l'âge de 50 ans est inférieure à 0,3%(4). En revanche, ce risque augmente d'au moins 10% chez les femmes enceintes ayant des antécédents personnels ou familiaux de thrombo-embolie veineuse (4). Les femmes enceintes qui sont homozygotes pour le facteur V Leiden, sans antécédents personnels de maladie thromboembolique veineuse ou un touché au premier degré ont un risque de 1-2% pour la maladie thromboembolique veineuse, tandis que ceux avec une telle histoire ont un risque 17% (4).
- Prothrombine G20210A:Il s'agit d'une mutation ponctuelle qui entraîne des niveaux élevés de prothrombine circulant (3). La mutation G20210A de la prothrombine est présent dans environ 3% de la population européenne, et il a été rapporté pour tenir compte de 17% des cas de thrombo-embolie veineuse pendant la grossesse (5). Comme avec le facteur V Leiden, une histoire personnelle ou des antécédents de maladie thromboembolique veineuse chez un parent au premier degré avant l'âge de 50 ans augmente le risque de thromboembolie veineuse pendant la grossesse. Sans une telle histoire, porteurs de la mutation G20210A de la prothrombine ont un risque inférieur à 0,5% de la thromboembolie veineuse pendant la grossesse; pour un transporteur avec une telle histoire, le risque est supérieur à 10%(5). Les femmes enceintes qui sont homozygotes pour la prothrombine G20210A mutation sans antécédents personnels ou familiaux positifs ont un risque de 2-3% de la thromboembolie veineuse pendant la grossesse, alors qu'une telle histoire confère un risque beaucoup plus grand. La combinaison du facteur V Leiden et prothrombine G20210A mutations a effets synergiques d'hypercoagulabilité. Ceux qui sont hétérozygotes pour cette combinaison, bien que présent dans seulement 1 pour 10.000 patients, ont un risque de 4-5% de la thromboembolie veineuse, même sans antécédents familiaux personnels (4),(5).
- Déficit en protéine C:Il a été lié à plus de 160 mutations distinctes qui produisent un phénotype très variable (3). La prévalence de déficit en protéine C est 0,2-0,3% lorsqu'elle est déterminée par un test fonctionnel avec une coupure de 50-60%. Le risque de thromboembolie veineuse pendant la grossesse chez les patients de la protéine C typique déficiente avec une histoire personnelle ou familiale a été signalé comme étant de 2-7% (6). Bien que rare, les nouveau-nés homozygotes pour déficit en protéine C sera de développer un purpura fulminans néonatal et nécessitent une anticoagulation à vie (6).
- Déficit en protéine S: Il a généralement deux causes, un gène réduit au silence, ou une mutation, qui se traduit par des niveaux d'antigène réduite protéine S libre et de l'activité (3). Détection de déficit en protéine S en utilisant des tests d'activité seule est soumise à une variabilité importante en raison de fluctuations du taux de protéine de liaison de la protéine S chez la femme enceinte (7). Par conséquent, le dépistage pendant la grossesse est nécessaire, des valeurs seuils pour les niveaux protéine S libre antigène dans les deuxième et troisième trimestres ont été identifiées à moins de 30% et moins de 24%, respectivement(1). Parmi ceux qui ont des antécédents familiaux positifs, le risque de thromboembolie veineuse pendant la grossesse a été rapportée pour être 6-7%(7). Comme avec déficit en protéine C, les résultats carence protéique homozygote S dans un purpura fulminans néonatal (6).
- Déficit en antithrombine: Il est hautement thrombogène, mais rares, les plus de 250 mutations associées peuvent diminuer la transcription du gène, conduisant à des réductions à la fois l'antigène et de l'activité, ou de modifier la structure et la fonction conduisant à des niveaux d'antigènes normaux, mais baisse de l'activité (8) . L'état très rare homozygote est associée à une activité antithrombine peu ou pas. La prévalence de la carence en antithrombine est d'environ 1 par 2500 patients (8) . Chez les patients non enceintes, le risque de thromboembolie veineuse chez les patients présentant un déficit en antithrombine est augmenté de plus de 25 fois. La grossesse peut augmenter le potentiel thrombogène de déficit en antithrombine sensiblement (8) . Toutefois, ce risque peut être beaucoup plus faible en l'absence d'une histoire personnelle positive ou de la famille.
- Méthylènetétrahydrofolate réductase (MTHFR): homozygotie pour cette mutation génétique est la cause la plus commune de l'hyperhomocystéinémie. L'homozygotie pour la MTHFR C677T et A1298C polymorphismes est présent dans 10-16% et 4-6% de tous les Européens, respectivement (9). Cependant, les mutations MTHFR par eux-mêmes ne semblent pas indiquer une augmentation du risque de maladie thromboembolique veineuse chez les femmes non enceintes ou soit enceinte (9). Bien que l'hyperhomocystéinémie a été précédemment rapporté pour être un facteur de risque modeste de la maladie thromboembolique veineuse, des données récentes indiquent que les niveaux élevés d'homocystéine sont un facteur de risque faible de thromboembolie veineuse (10) . Cette observation peut s'expliquer par le régime alimentaire en acide folique abonde des pays développés, y compris des études de supplémentation en folates avec de la vitamine B supplémentation chez les patients non enceintes ne montrent pas de réduction de la thrombo-embolie veineuse. Ainsi, il n'y a pas suffisamment de preuves pour soutenir l'évaluation des polymorphismes MTHFR ou de mesure des niveaux d'homocystéine à jeun dans l'évaluation d'une étiologie thrombophilie de thromboembolie veineuse, et, par conséquent, il n'est pas recommandé.
- Thrombophilies Autres: Une variété de thrombophilies autres ont été décrites, y compris les mutations de substitution dans le gène du facteur V, une mutation dans le gène promoteur de PAI-1, protéine Z déficit, et l'activité d'amélioration des mutations dans des gènes différents facteurs de la coagulation. Bien qu'ils semblent exercer peu de risque indépendant de maladie thromboembolique veineuse, ils peuvent aggraver le risque chez les patients avec les mutations mentionnées ci-dessus. Cependant, il ya suffisamment de preuves pour recommander le dépistage de ces thrombophilies.
Thrombophilies héréditaires et issues défavorables de grossesse
Le rôle que thrombophilies héréditaires ou acquises peuvent jouer dans la pathogenèse de la prééclampsie a été soigneusement étudié pendant plusieurs années. Les données de cette étude (11) montrent que la thrombophilie est associée à une augmentation de plus de 2,5 fois du risque de récidive de prééclampsie. Les résultats étaient similaires dans le sous-ensemble des femmes ayant le facteur V Leiden et du facteur mutations II, la forme la plus commune de thrombophilie héréditaire. L'observation que les patients qui ont déjà eu la pré-éclampsie sont à risque accru de développement ultérieur d'épisodes thrombo-emboliques est en outre preuves épidémiologiques reliant thrombophilie et la pré-éclampsie. Facteur V Leiden et du facteur II et mutations thrombophilie augmentera le risque de récidive de prééclampsie, et les femmes qui ont des antécédents de prééclampsie devraient être examinés pour thrombophilie pour identifier un groupe à risque élevé de femmes qui peuvent être admissibles à des essais d'intervention (11) . Les méta-analyses et une étude de cohorte rétrospective ont révélé une association entre thrombophilies héréditaires et pertes au premier trimestre de grossesse (12) . Le Eunice Kennedy Shriver National Institute of Child Health et materno-foetale sur le développement humain de la médecine Réseau d'unités testées femmes à faible risque avec une grossesse unique de moins de 14 semaines de gestation. La médecine maternelle et foetale Réseau d'unités identifié 134 femmes qui étaient hétérozygotes pour le facteur V Leiden parmi les 4,885 femmes enceintes, et n'a trouvé aucune augmentation de l'incidence de la perte du foetus (13) . Des résultats similaires de pas de risque accru de perte ftale ont été notées pour les transporteurs maternelle de la prothrombine G20210A mutation du gène(13).
Examiner les études cas-témoins multiples, de cohorte et systématique n'ont pas réussi à détecter une association significative entre le facteur V Leiden et la restriction de croissance intra-utérin (RCIU) inférieur au 10e percentile ou moins que le 5e percentile (14) . Un manque similaire de l'association a été notée entre la prothrombine G20210A mutation et RCIU (14) . Dans l'ensemble, il ya suffisamment de preuves pour établir un lien entre thrombophilie et le décollement placentaire. Analyses prospectives de cohortes de facteur V Leiden, la prothrombine G20210A , et issue de la grossesse n'ont trouvé aucune association avec un décollement placentaire (15). L'étude homocystéine Hordaland trouvé une association entre un décollement placentaire et l'hyperhomocystéinémie supérieure à 15 micromoles association / L, mais minimal entre l'homozygotie pour le polymorphisme C677T MTHFR et le décollement placentaire(15).
Considérations cliniques
Dépistage des thrombophilies dans la controverse. Il est utile uniquement lorsque les résultats auront une incidence sur les décisions de gestion, et n'est pas utile dans les situations où le traitement est indiqué pour d'autres facteurs de risque. Le dépistage peut être pris en compte dans les paramètres cliniques suivants:
- Une histoire personnelle de la maladie thromboembolique veineuse qui a été associée à des facteurs de risque non-récurrentes (par exemple, les fractures, la chirurgie, et d'immobilisation prolongée). Le risque de récurrence chez les femmes enceintes non traitées avec une telle histoire et une thrombophilie était de 16% (16).
- Un parent au premier degré (par exemple, un parent, frère ou sur) avec une histoire à haut risque thrombo-embolie veineuse ou thrombophilie avant l'âge de 50 ans en l'absence de facteurs de risque autres autant que les femmes touchées devraient recevoir une prophylaxie.
Dans d'autres situations, les tests thrombophilie n'est pas systématiquement recommandée. Test de thrombophilies héréditaires chez les femmes qui ont subi des pertes ftales récurrentes ou décollement placentaire n'est pas recommandé. Bien qu'il puisse y avoir une association dans ces cas, il n'y a pas suffisamment de preuves cliniques que la prophylaxie antepartum avec l'héparine non fractionnée ou héparine de bas poids moléculaire (HBPM) prévient la récidive chez ces patients (17) . Cependant, le dépistage des anticorps antiphospholipides peut être appropriée chez les patients qui subissent une perte ftale. En outre, il n'y a pas de preuves suffisantes d'une association, et, par conséquent, suffisamment de preuves pour soit l'écran ou de traiter les femmes avec thrombophilies héréditaires et des histoires obstétricales qui incluent des complications telles que la prééclampsie ou IUGR.
Tests de laboratoire pour thrombophilies
Chaque fois que possible, des tests de laboratoire doivent être effectués à distance (après 6 semaines) de l'événement thrombotique et alors que la patiente n'est pas enceinte et ne prenant pas d'anticoagulation ou la thérapie hormonale.
Les tests recommandés sont énumérés ci-dessous(18):
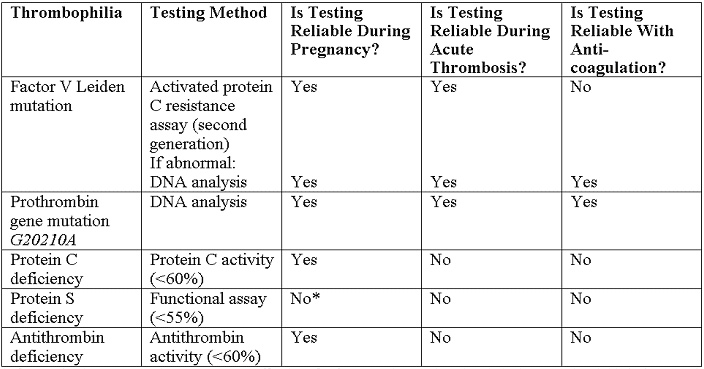
*NOTE - Si le dépistage pendant la grossesse est nécessaire, des valeurs seuils pour les niveaux protéine S libre antigène dans les deuxième et troisième trimestres ont été identifiées à moins de 30% et moins de 24%, respectivement.
Schémas anticoagulants pour les femmes enceintes
Étant donné le risque et le ratio bénéfice de l'héparine non fractionnée, HBPM est généralement l'agent préféré pour la prophylaxie pendant la grossesse. Tous les patients atteints de thrombophilies héréditaires devraient subir une évaluation individualisée des risques, qui peuvent modifier les décisions de gestion. La nécessité d'ajuster la dose en fonction de HBPM anti-Xa est controversée. Divers l'héparine non fractionnée et les schémas d'HBPM sont décrites ci-dessous (18):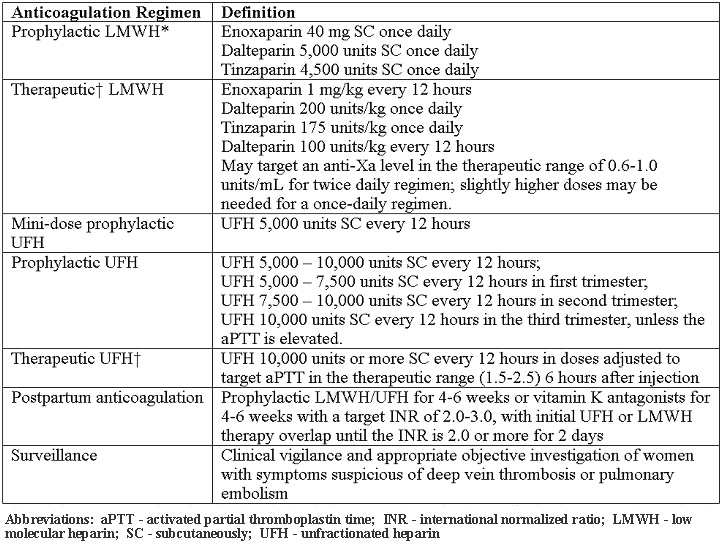
*Bien que dans des conditions extrêmes de poids corporel, la modification de la dose peut être nécessaire
On parle aussi de poids ajusté, la dose de traitement complet
Thromboprophylaxie recommandée pour les grossesses compliquées par thrombophilies héréditaires:
La décision de traiter avec une thromboprophylaxie, un traitement anticoagulant, ou pas de traitement pharmacologique (surveillance prénatale) est influencée par l'histoire thrombo-embolie veineuse, la gravité de la thrombophilie héréditaire, et les facteurs de risque supplémentaires. Tous les patients atteints de thrombophilie héréditaire devraient subir une évaluation individualisée des risques, qui peuvent modifier les décisions de gestion. La décision concernant l'intensité du traitement peut être influencé par d'autres facteurs de risque, tels que l'accouchement par césarienne, une immobilité prolongée, l'obésité et des antécédents familiaux de thrombophilie ou thrombo-embolie veineuse. Nos recommandations sont les suivantes:
- Faible risque de thrombophilie (facteur V Leiden hétérozygote; prothrombine G20210A hétérozygote; protéine C ou déficit en protéine S) des patients sans antécédents de maladie thromboembolique veineuse (MTEV): surveillance sans traitement anticoagulant ou une HBPM prophylactique ou HNF est généralement recommandé. En matière de surveillance post-partum sans traitement anticoagulant ou un traitement anticoagulant post-partum si le patient présente des facteurs de coagulation supplémentaires (par exemple, au premier degré par rapport à l'histoire d'un épisode thrombotique avant l'âge de 50 ans, l'obésité, l'immobilité prolongée).
- Patients à faible risque thrombophilie avec un seul épisode précédent de la TEV - qui ne reçoivent pas un traitement anticoagulant à long terme: prophylactique ou intermédiaire-dose de surveillance HBPM / HNF ou sans traitement anticoagulant est recommandé. Dans un traitement anticoagulant post-partum ou intermédiaire-dose d'HBPM / HNF.
- À haut risque (thrombophilie déficit en antithrombine, hétérozygote double pour la prothrombine G20210A mutation facteur V Leiden et, facteur V Leiden homozygote ou prothrombine G20210A homozygotes mutation) les patients sans antécédents de TEV: HBPM ou HNF prophylactique et un traitement anticoagulant post-partum.
- Patients à haut risque thrombophilie avec un seul épisode précédent de la TEV - qui ne reçoivent pas un traitement anticoagulant à long terme: prophylactique, intermédiaire dose, ou dose ajustée HBPM / HNF régime, et dans un traitement anticoagulant post-partum ou intermédiaire ou HBPM à dose ajustée / HNF pendant 6 semaines est des recommandations habituelles. Niveau traitement doit être au moins aussi élevé que le traitement avant l'accouchement.
- Pas de thrombophilie avec l'épisode précédent single de TEV associé à des facteurs de risque transitoire qui n'est plus présente - exclut la grossesse ou facteur de risque des oestrogènes: surveillance sans traitement anticoagulant pendant la grossesse et du post-partum thérapie de coagulation est soutenu par de nombreux experts.
- Thrombophilie ou pas thrombophilie avec deux épisodes ou plus de TEV - qui ne reçoivent pas un traitement anticoagulant à long terme: HBPM prophylactique ou thérapeutique à dose unique ou HNF prophylactique ou thérapeutique à dose est recommandé pendant la période prénatale. Traitement anticoagulant post-partum ou thérapeutique HBPM à dose / UFH pendant 6 semaines est recommandé.
Gestion intrapartum pour les patients thrombophiliques
L'utilisation de bottes pneumatiques de compression ou des bas élastiques doit être envisagée chez les patients ayant une thrombophilie connue jusqu'à ce qu'ils soient post-partum ambulatoire. En outre, la prophylaxie intrapartum avec l'héparine non fractionnée doit être envisagée chez les patients à risque élevé. Peu importe si le patient reçoit des doses prophylactiques, intermédiaires, ou thérapeutiques d'HBPM, il faudrait envisager de substituer une dose comparable de l'héparine non fractionnée à 36 semaines de gestation afin de permettre l'induction de l'anesthésie neuraxiale travail et l'accouchement (19) . Sinon, à dose ajustée sous-cutanée ou HBPM l'héparine non fractionnée peut être interrompu 24-36 heures avant l'induction du travail ou d'une césarienne planifiée afin d'éviter l'effet anticoagulant pendant la grossesse. Les patients recevant une anticoagulation prophylactique doit être 'instruction de suspendre leurs injections au début du travail. Si l'accouchement vaginal ou par césarienne est plus de 4 heures après une dose prophylactique d'héparine non fractionnée, le patient n'est pas un risque important de complications hémorragiques. Au-delà de 12 heures après une dose prophylactique ou 24 heures après une dose thérapeutique d'une HBPM, la rachianesthésie ne doit pas être retenu parce que le risque de la procédure liée à une hémorragie est limitée (20) . Les patients recevant l'héparine non fractionnée ou une HBPM qui ont besoin d'inversion rapide de l'effet anticoagulant de livraison peuvent être traitées avec du sulfate de protamine (20) . En outre, l'antithrombine concentrés peuvent être utilisés dans l'anti-thrombine patients déficients en cours de la période périnatale.
Post-partum de gestion
Doses du post-partum de l'héparine non fractionnée ou une HBPM doit être égale ou supérieure à la thérapie prénatale. L'héparine non fractionnée ou une HBPM peuvent être redémarrés en 4-6 heures après l'accouchement par voie vaginale ou 6-12 heures après l'accouchement par césarienne. Les patients qui seront traités par la warfarine peut commencer le traitement immédiatement après l'accouchement. La dose initiale de warfarine doit être de 5 mg par jour pendant 2 jours, avec les doses suivantes déterminées par le suivi du rapport international normalisé (RIN). Pour éviter la thrombose paradoxal et nécrose de la peau de l'effet C antiprotein début de la warfarine, les femmes devraient être maintenus sur les doses thérapeutiques d'héparine non fractionnée ou une HBPM pendant 5 jours et jusqu'à ce que l'INR soit thérapeutique (2,0-3,0) pour 2 jours consécutifs. Parce que la warfarine, des HBPM et l'héparine non fractionnée ne s'accumulent pas dans le lait maternel et ne pas provoquer un effet anticoagulant chez le nourrisson, ces anticoagulants sont compatibles avec l'allaitement (21), (22).
Le risque de TEV chez les femmes utilisant l'oestrogène de contraceptifs oraux contenant augmente de 35 à 99 fois et 16 fois chez les femmes hétérozygotes pour le facteur V Leiden et G20210A de la prothrombine mutation, respectivement (23) . Le risque annuel de la TEV est de 5,7 pour 10.000 chez les porteurs du facteur V Leiden, par rapport à 28,5 pour 10.000 chez les femmes de facteur V Leiden hétérozygotes en utilisant des contraceptifs contenant des strogènes, le risque relatif de 34,7 (24) . Par conséquent, des méthodes alternatives, telles que les dispositifs intra-utérins (y compris ceux contenant un progestatif), les pilules progestatives ou implants, et les méthodes de barrière, doit être considéré. Cependant, le dépistage pour toutes les femmes avant d'initier la contraception thrombophilies association n'est pas recommandée.
Ftale thrombophilie, paralysie périnatale des maladies et cérébrale
Thrombophilie décrit un spectre de troubles de la coagulation congénitaux ou acquis liés à la thrombose veineuse et artérielle. Ces troubles peuvent se manifester chez la mère ou du foetus, ou dans les deux simultanément. Ftale thrombophilie a une incidence de 2,4 à 5,1 cas pour 100.000 naissances (25) . Alors que la mère de thrombophilie a une incidence plus élevée par la suite, à la fois maternelle et ftale thrombophilie peut conduire à des effets indésirables maternels et ftaux. Thrombophilie conduit à une thrombose à l'interface maternelle ou foetale. Lorsque la thrombose se produit du côté maternel, la conséquence peut être sévère pré-éclampsie, RCIU, décollement placentaire, ou de la perte du foetus. Thrombose sur le côté du ftus peut être une source d'embolie qui contournent hépatique et la circulation pulmonaire et les voyages vers le cerveau du foetus (25) . En conséquence, le nouveau-né peut soutenir un événement catastrophique tel que la course artérielle périnatale par une thrombose artérielle, thrombose veineuse cérébrale du sinus, ou une thrombose veineuse rénale.
AVC périnatal est défini comme un événement vasculaire cérébral qui se produit entre 28 semaines de gestation et 28 jours d'âge postnatal (26) . L'incidence est d'environ 17 à 93 cas pour 100.000 naissances vivantes (26) . accident vasculaire cérébral néonatal survient chez environ 1 sur tous les 4000 naissances vivantes. En outre, 1 dans tous les nouveau-nés de 2300 à 4000 est donné un diagnostic d'AVC ischémique dans la pépinière (26) . Artérielle AVC ischémique dans les comptes-nés pour 50% à 70% des cas de paralysie cérébrale congénitale hémiplégique. Facteur V Leiden mutation, mutation du gène de la prothrombine, et un déficit de la protéine C, protéine S, antithrombine III et ont pris en commun dans deux études, été identifiés dans plus de 50% des accidents vasculaires cérébraux ischémiques cérébraux (27) . En plus de ces thrombophilies, les facteurs de risque importants d'accident vasculaire cérébral périnatale et néonatale comprennent:
- Une thrombose dans villosités placentaires ou des navires;
- Infection;
- Utilisation d'un cathéter intravasculaire.
Quelles sont les causes périnatales course?
Le mécanisme sous-tend que l'AVC périnatal est un événement thrombo-embolique qui provient soit d'un navire intracrânienne ou extracrânienne, le cur, ou le placenta (27) . Une récente méta-analyse a révélé une corrélation statistiquement significative entre déficit en protéine C, MTHFR C677T, et la première occurrence d'accident vasculaire cérébral ischémique artérielle dans la population pédiatrique (28) . Le cerveau est l'organe le plus important et les plus vulnérables du foetus sensibles à thrombus qui se forment dans le placenta soit ou ailleurs. La présence de lésions vasculaires sévères ftales étroitement corrélée à une atteinte neurologique et la paralysie cérébrale. Une constatation pathologique, du ftus vasculopathie thrombotique (FTV), a été associée à une lésion cérébrale.
La paralysie cérébrale est la déficience motrice chronique la plus fréquente de l'enfance. Environ 2 à 2,5 enfants sur 1000 sont donnés un diagnostic de ce trouble chaque année (29) . La condition apparaît tôt dans la vie, ce n'est pas le résultat d'une maladie évolutive reconnue. Les facteurs de risque pour la paralysie cérébrale sont multiples et hétérogènes: la prématurité, l'hypoxie et l'ischémie, et la thrombophilie. Bien que la thrombophilie est un facteur de risque reconnu pour la paralysie cérébrale, la force de l'association n'a pas encore été pleinement étudié. Malheureusement pour les patients et de leur progéniture, des preuves sur la relation entre thrombophilie et un résultat neurologique défavorable n'est pas suffisamment forte pour offrir beaucoup de la manière de formuler des recommandations définitives pour les obstétriciens. Nous suggérons, certaines recommandations provisoires sur la gestion: envisager le dépistage lorsque la paralysie cérébrale se produit en association avec AVC périnatal, le dépistage du ftus et la mère de la thrombophilie peut être réalisée (27) , (30) . Le panneau comprend recommandée thrombophilie tests pour:
- Facteur V Leiden;
- Prothrombine G20210A;
- Anticorps anticardiolipine;
- Mutation MTHFR.
Dépistage familial a également été suggéré dans les cas suivants: 1) plusieurs facteurs de risque prothrombotiques dans un nouveau-né affectés, et 2) une histoire familiale positive. Le rapport coût-efficacité du dépistage de la thrombophilie n'a pas été évalué dans des études prospectives, car la valeur prédictive positive d'un tel dépistage est extrêmement faible.
Résumé
Thrombophilies héréditaires sont un groupe hétérogène de troubles de la coagulation qui prédisposent les individus à des événements thrombo-emboliques. Ils sont facteurs de risque majeurs de thrombo-embolie pendant la grossesse et le post-partum. En outre, thrombophilies ont été impliqués dans une variété d'événements obstétricaux indésirables, y compris la perte de la grossesse (en particulier la mort du ftus), la pré-éclampsie, décollement placentaire, et RCIU. La physiopathologie est incertaine, mais on pense à associer une thrombose dans la circulation utéro-placentaire, ce qui conduit à un infarctus et d'insuffisance placentaire. Par conséquent, un traitement anticoagulant a le potentiel pour améliorer les résultats obstétriques chez les femmes atteintes héréditaires thrombophilies. Issues de la grossesse chez les femmes asymptomatiques ayant thrombophilies héréditaires sont souvent bonnes. Par conséquent, le traitement de routine avec une thromboprophylaxie ne peut être justifiée chez ces femmes. Hérité des tests thrombophilie chez les femmes qui ont subi des pertes ftales récurrentes ou décollement placentaire n'est pas recommandé car il est difficile de savoir si l'anticoagulation réduit la récurrence. En raison de l'absence d'association entre la mutation MTHFR et les résultats négatifs de grossesse, le dépistage avec les niveaux d'homocystéine à jeun ou des analyses de mutation MTHFR n'est pas recommandé. Dépistage des thrombophilies héréditaires doivent inclure le facteur V Leiden mutation; prothrombine G20210A mutation, et l'antithrombine, protéine C, protéine S et les carences. Tous les patients atteints de thrombophilies héréditaires devraient subir une évaluation individualisée des risques, qui peuvent modifier les décisions de gestion. Post-partum de la warfarine, HBPM, et l'anticoagulation l'héparine non fractionnée peut être utilisé chez les femmes qui allaitent. Une mère dont le bébé a reçu un diagnostic de thrombophilie et les accidents cérébrovasculaires ftale ou néonatale peut être offert thromboprophylaxie (héparine et l'aspirine) pendant toute la grossesse suivante. L'utilité de cette intervention n'a pas été bien étudié et repose uniquement sur ??l'opinion d'experts, cependant, il est donc impératif de conseiller les patients sur les risques et les avantages de la thérapie prophylactique avance.
Remerciements: nous remercions le Dr. John R. Higgins, professeur d'obstétrique et de gynécologie, Chef du Collège de médecine et de la santé, University College Cork, Cork Hôpital Maternité Université, Wilton, Cork, pour servir à titre de réviseur et des suggestions utiles pour la compilation du manuscrit.
Références
- Paidas MJ, Ku DH, Lee MJ, et al. Protein Z, protein S levels are lower in patients with thrombophilia and subsequent pregnancy complications. J Thromb Haemost 2005;3:497-501. (Level II-3)
- Chang J, Elam-Evans LD, Berg CJ, et al. Pregnancy-related mortality surveillance United States, 1991-1999. Morb Mortal Wkly Rep Survell Summ 2003;52:1-8. (Level II-3)
- Franco RF, Reitsma PH. Genetic risk factors of venous thrombosis. Hum Genet 2001;109:369-384. (Level III)
- Zotz RB, Gerhardt A, Scharf RE. Inherited thrombophilia and gestational venous thromboembolism. Best Pract Res Clin Haematol 2003;16:243-259. (Level III)
- Gerhardt A, Scharf RE, Beckman MW, et al. Prothrombin and factor V mutations in women with a history of thrombosis during pregnancy and the puerperium. N Engl J Med 2000;342:374-380. (Level II-3)
- De Stefano V, Leone G, Mastranglo S, et al. Thrombosis during pregnancy and surgery in patients with congenital deficiency of antithrombin III, protein C, protein S. Thromb Haemost 1994;71:799-800. (Level III)
- Goodwin AJ, Rosendaal FR, Kottke-Marchant K, et al. A review of the technical, diagnostic, and epidemiologic considerations for protein S assays. Arch Pathol Lab Med 2002;126:1349-1366. (Level III)
- Carraro P. Guidelines for the laboratory investigation of inherited thrombophilias. Recommendations for the first level clinical laboratories. European Communities Confederation of Clinical Chemistry and Laboratory Medicine. Working Group on Guidelines for Investigation of Disease. Clin Chem Lab Med 2003;41:382-391. (Level III)
- Domagala TB, Adamek L, Nizankowska E, et al. Mutations C677T and A1298C of the 5,10-methylenetetrahydofolate reductase gene and fasting plasma homocysteine levels are not associated with the increased risk of venous thromboembolic disease. Blood Coagul Fibronolysis 2002;13:423-431. (Level II-3)
- de Heijer M, Willems HP, Blom HJ, et al. Homocysteine lowering by B vitamins and the secondary prevention of deep vein thrombosis and pulmonary embolism: A randomized, placebo-controlled, double-blind trial. Blood 2007;109:139-144. (Level I)
- Facchinetti F, Marozio L, Frusca T, et al. Maternal thrombophilia and the risk of recurrence of preeclampsia. Am J Obstet Gynecol 2009;200:46.e1-46.e5
- Lissalde-Lavigne G, Fabbro-Peray P, Cochery-Nouvellon E, et al. Factor V Leiden and prothrombin G20210A polymorphisms as risk factors for miscarriage during a first intended pregnancy: the matched case-control 'NOHA first' study. J Thromb Heamost 2005;3:2178-2184. (Level II-2)
- Silver RM, Zhao Y, Song Y, et al. Prothrombin gene G20210A mutation and obstetric complications. Eunice Kennedy Shriver National Institute of Child Health and Human Development Maternal-Fetal Medicine Units (NICHD MFMU) Network. Obstet Gynecol 2010;115:14-20. (Level II)
- Infante-Rivad C, Rivard GE, Yotov WV, et al. Absence of association of thrombophilia polymorphisms with intrauterine growth restriction. N Enlg J Med 2002;347:19-25. (Level II-2)
- Nurk E, Tell GS, Refsum H, Ueland PM, et al. Factor V Leiden, pregnancy complications and adverse outcomes: the Hordaland Homocysteine Study. QJM 2006;99:289-298. (Level II-2)
- Brill-Edwards P, Ginsberg JS, Gent M, et al. Recurrence of clot in This Pregnancy Study Group. Safety of withholding heparin in pregnant women with a history of venous thromboembolism. Recurrence of Clot in This Pregnancy Study Group. N Engl J Med 2000;343:1439-1444. (Level I)
- Kanndorp D, Di Nisio M, Goddijn M, et al. Aspirin or anticoagulants for treating recurrent miscarriage in women without antiphospholipid syndrome. Cochrane Database of Systematic Reviews 2009; Issue 1. Art. No.: CD004734. DOI: 10.1002/14651858.CD004734.pub3. (Level III)
- American College of Obstetricians and Gynecologists. Inherited thrombophilias in pregnancy; practice bulletin No. 124, September 2011. Obstet Gynecol 2011;118:730-740
- Horlocker TT, Wedel DJ, Benzon H, et al. Regional anesthesia in the anticoagulated patient: defining the risks (the second ASRA Consensus Conference on Neuroaxial Anesthesia and Anticoagulation). Reg Anesth Pain Med 2003;28:172-197. (Level III)
- Duhl AJ, Paidas MJ, Ural SH, et al. Antithrombotic therapy and pregnancy: consensus report and recommendations for prevention and treatment of venous thromboembolism and adverse pregnancy outcomes. Pregnancy and Thrombosis Working Group. Am J Obstet Gynecol 2007;197:457.e1-457.e21
- Richter C, Sitzmann J, Lang P, et al. Excretion of low molecular weight heparin in human milk. Br J Clin Pharmacol 2001;52:708-710. (Level III)
- Clark SL, Porter TF, West FG. Coumarin derivatives and breastfeeding. Obstet Gynecol 2000;95:938-940
- Gomes MP, Deitcher SR. Risk of venous thromboembolic disease associated with hormonal contraceptives and hormone replacement therapy: a clinical review. Arch Intern Med 2004;164:1965-1976. (Level III)
- American College of Obstetricians and Gynecologists. Use of hormonal contraception in women with coexisting medical conditions. ACOG Practice Bulletin No. 73. Obstet Gynecol 2006;107:1453-1472. (Level III)
- Lee J, Croen LA, Backstrand KH, et al. Maternal and infant characteristics associated with perinatal arterial stroke in the infant. JAMA 2005;293:723-729
- Nelson KB. Thrombophilias, Thrombosis and Outcome in Pregnancy, Mother, and Child Symposium. Society of Maternal-Fetal Medicine 26th Annual Meeting. Miami Beach, FL; 2006
- Nelson KB, Lynch JK. Stroke in newborn infants. Lancet Neurol 2004;3:150-158
- Winter S, Autry A, Boyle C, et al. Trends in the prevalence of cerebral palsy in a population-based study. Pediatrics 2002;110:1220-1225
- American College of Obstetricians and Gynecologists and American Academy of Pediatrics. Neonatal Encephalopathy and Cerebral Palsy: Defining the Pathogenesis and Pathophysiology. Washington DC: The American College of Obstetricians and Gynecologists; September 2003
- Gibson CS, MacLennan AH, Goldwater PN, et al. Antenatal causes of cerebral palsy: associations between inherited thrombophilias, viral and bacterial infection, and inherited susceptibility to infection. Obstet Gynecol Surv 2003;58:209-220
Publié: 4 June 2012
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


