Toxoplasmosis: Infección perinatal Parasitarias
WHEC Boletín de la práctica clínica y directrices de gestión de los proveedores de atención médica.Educación subvención concedida por el Women's Health and Education Center (WHEC).
Muchas de las infecciones parasitarias están asociadas con graves consecuencias maternas y fetales si se adquiere durante el embarazo. En general, las infecciones perinatales tener consecuencias más graves del feto cuando se producen temprano en la gestación, porque el primer trimestre, las infecciones pueden alterar la organogénesis. Infecciones Segundo y tercer trimestre puede causar trastornos neurológicos o trastornos de crecimiento. Toxoplasma gondii deriva su nombre específico de la gondii, un roedor del norte de África de la que este protozoo fue aislado por primera vez en 1908. La distribución del organismo es ubicuo. T gondii posee la capacidad de atravesar las líneas de las especies y establecer la infección, no sólo en los animales domésticos del hombre, pero en el hombre mismo. Toxoplasma existe en la naturaleza en tres formas, el trofozoito, el quiste y los ooquistes. El modo de transmisión más importante de infección para el hombre es a través de la ingestión de carne mal cocida que contiene organismos enquistados. La infección humana se produce cuando se ingiere la carne infectada o cuando la comida está contaminada con heces de gato, a través de las moscas, cucarachas, o los dedos. Las tasas de infección son más altas en áreas con mala higiene y condiciones de hacinamiento. Gatos y los gatos domésticos que comen carne cruda es más probable que portan el parásito. El quiste es destruido por el calor. Un gato susceptibles carece de anticuerpos contra T gondii se infecte después de la ingestión de alimentos que contengan organismos enquistados y se excretan ooquistes durante varias semanas. Aproximadamente el 50% de los felinos, posteriormente impugnada por la alimentación de quiste de nuevo van a excretar ooquistes, lo que indica la probabilidad de que varias veces un gato puede ser infecciosa durante toda la vida. Los gatos que cazan o comer carne cruda por la contaminación de su excreción fecal de ooquistes puede constituir un riesgo potencial para pacientes embarazadas.
El propósito de este documento es describir el modo de transmisión de la toxoplasmosis, los efectos maternos y fetales, y ofrecer directrices para el asesoramiento y la gestión durante el embarazo. Las infecciones parasitarias están asociadas con graves consecuencias maternas y fetales si se adquiere durante el embarazo. La toxoplasmosis congénita y la prevención son también discutidos en esta revisión. Las mujeres embarazadas que adquieren la toxoplasmosis debe ser tratada. El tratamiento de las mujeres embarazadas con toxoplasmosis aguda reduce pero no elimina el riesgo de infección congénita.
Epidemiología:
La toxoplasmosis es causada por el parásito intracelular Toxoplasma gondii. T existe en varias formas: el trofozoito, que es la forma invasiva, y un quiste o un ooquiste, que son formas latentes. El ciclo de vida de T. gondii es dependiente de los gatos salvajes y domésticos, que son el único huésped de los ooquistes. Los ooquistes se forma en el intestino del gato y, posteriormente, se excreta en las heces. Los mamíferos, como las vacas, la ingesta de ooquistes, que se interrumpe en el intestino de los animales, la liberación de los trofozoítos invasoras. El trofozoito luego se difunde en todo el cuerpo, en última instancia, la formación de quistes en el cerebro y los músculos. La infección humana se adquiere por consumo de quistes en la carne mal cocida de animales infectados, por la contaminación de los alimentos de insectos, por el contacto con ooquistes provenientes de las heces de gatos infectados (el único huésped definitivo), o por contacto con material infectado de insectos en el suelo (1) . La infección con T. gondii suele ser asintomática, aunque después de una incubación de 5-18 días, algunos síntomas no específicos puede ocurrir. Aproximadamente de 40 a 50% de los adultos en los Estados Unidos tienen anticuerpos frente a este organismo, y la prevalencia de anticuerpos es más alta en las poblaciones de bajo nivel socioeconómico. La frecuencia de la seroconversión durante el embarazo es del 5%, y aproximadamente el 3 en 11.000 los niños muestran signos de infección congénita. Clínicamente significativa la toxoplasmosis congénita se presenta en aproximadamente 1 de cada 8.000 embarazos. La toxoplasmosis es más común en Europa Occidental, especialmente Francia, probablemente debido a la práctica en ese país de comer carne cruda o poco comunes. Más del 80% de las mujeres en edad fértil en París, han de anticuerpos a T. gondii, la incidencia de la toxoplasmosis congénita es dos veces más frecuentes que en los Estados Unidos (2).
Aproximadamente el 20-25% de las mujeres en edad de procrear en los Estados Unidos muestran evidencia serológica de infección anterior T gondii. Aunque la prevalencia de la infección aumenta con la edad antes, en ningún momento de haber alcanzado la alta incidencia observada en una población comparable en algunos países tropicales y Francia. En los Estados Unidos, 2.6 mujeres por cada 1.000 mujeres sero-susceptibles a contraer la infección durante el embarazo. Aproximadamente un tercio de las mujeres que adquieren la toxoplasmosis durante el embarazo, transmitir la infección a su descendencia. Cuanto más tarde en la gestación de la infección materna se adquiere, mayor es la probabilidad de afectación fetal. Cuando la infección se produce durante el primer trimestre del embarazo, aproximadamente el 14% de la descendencia serán infectadas, las cifras de infección adquirida durante el segundo y tercer trimestre son el 29% y 59%, respectivamente. Cuanto antes la infección se produce en el embarazo, el más grave es la enfermedad en el recién nacido. Casi todos los niños infectados nacidos de madres que adquieren la infección en el tercer trimestre se parecen normales al nacer y sólo meses o años después de desarrollar las manifestaciones clínicas de la infección.
Manifestaciones clínicas:
El organismo ingerido invade a través del epitelio intestinal y por vía hematógena se extiende por todo el cuerpo. La replicación intracelular conduce a la destrucción de la célula. Las manifestaciones clínicas de la infección son el resultado de daño en los órganos directa y la respuesta inmunológica después de la parasitemia y la muerte celular. La inmunidad del huésped está mediada principalmente a través de los linfocitos T (3). La mayoría de las infecciones en los seres humanos son sintomáticas. Incluso en ausencia de síntomas, sin embargo, los pacientes pueden tener evidencia de la participación de múltiples órganos, y la enfermedad clínica puede seguir un largo período de infección asintomática. Toxoplasmosis sintomática se presenta generalmente como una enfermedad similar a la mononucleosis. En contraste con la infección en el huésped inmunocompetente, la toxoplasmosis puede ser una devastadora infección en el paciente inmunodeprimido. Debido a la inmunidad de T gondii es mediada por células, los pacientes con infección por el virus de la inmunodeficiencia humana y en los tratados con el tratamiento inmunosupresor tras un trasplante de órganos, son particularmente susceptibles a la infección por nuevos o reactivados. En estos pacientes, la disfunción del sistema nervioso central es la manifestación más común de infección. Apreciación general incluyen la encefalitis, meningoencefalitis, y lesiones en masa intracerebral. Neumonitis, miocarditis, y linfadenopatía generalizada también son comunes.
Mayoría de los casos, la toxoplasmosis se presenta como linfadenopatía cervical asintomática, con síntomas que ocurren en sólo el 10-20% de los casos de adultos. Otros síntomas incluyen fiebre, malestar, sudores nocturnos, mialgias y hepatoesplenomegalia. La parasitemia puede ocurrir después de la infección, que en las mujeres embarazadas pueden semillas de la placenta y causar infección fetal posterior. La transmisión congénita de T. gondii depende del momento de la adquisición de la infección materna. Cuanto más tarde en la gestación que ocurra la infección, la transmisión más probable es que se produzca. El ritmo de aumento de la transmisión vertical del 10% al 15% en el primer trimestre, un 25% en el segundo trimestre, y más del 60% en el tercer trimestre (2). Dentro de la población obstétrica, la manifestación más comúnmente reconocida de la toxoplasmosis aguda es la linfadenopatía. Puede ser el signo de presentación única o puede haber una respuesta febril asociado. La ampliación del nodo focal puede implicar las regiones cervical, supraclavicular o inguinal, y con frecuencia unilateral. La biopsia nodular, en relación con la ausencia de linfadenitis significativa, las cuentas de la empresa, no de licitación, los ganglios linfáticos que suelen observarse. Con la enfermedad más avanzada, la fatiga es el síntoma más frecuente en la infección más grave. Puede estar asociada con dolor de cabeza, depresión mental, mialgias y fiebre de bajo grado intermitente. Una poliartritis migratorias y diversos tipos de erupciones predominantemente macular también se han descrito. En casos raros, dolor abdominal secundaria a la afectación de ganglios linfáticos mesentéricos puede ser el síntoma de presentación principal. Las manifestaciones más severas de la enfermedad sistémica son la miocarditis, meningoencefalitis, o ambos.
Diagnóstico:
El diagnóstico de la toxoplasmosis en la madre puede ser confirmada por métodos serológicos e histológicos. T gondii es más fáciles de identificar en linfático o tejido cerebral. Preparaciones histológicas pueden ser examinadas por la luz y microscopía electrónica. Para microscopía óptica, las muestras deben ser teñidas con cualquiera de Giemsa o manchas de Wright (4). La característica histológica principal de estos ganglios linfáticos está marcada hiperplasia de células reticulares. Microscópicamente, la arquitectura ganglionar es bastante bien conservado. La tríada típica de la enfermedad, que, sin embargo, está presente en todos los casos, está constituida por (hiperplasia a) folicular marcada, asociada con una intensa actividad mitótica y la fagocitosis de los desechos nucleares, (b) pequeños granulomas compuestos casi enteramente por células epiteliales , que se encuentra dentro de los folículos hiperplásicos y la periferia, invadiendo y desdibujar sus márgenes, y (c) la distensión de los senos marginales y cortical monocitoides células B. Una característica adicional es la presencia inmunoblastos y células plasmáticas en los cordones medulares (5). Variaciones sobre el tema incluyen la presencia en los granulomas de la necrosis o más de una Langhans ocasional »de células gigantes.
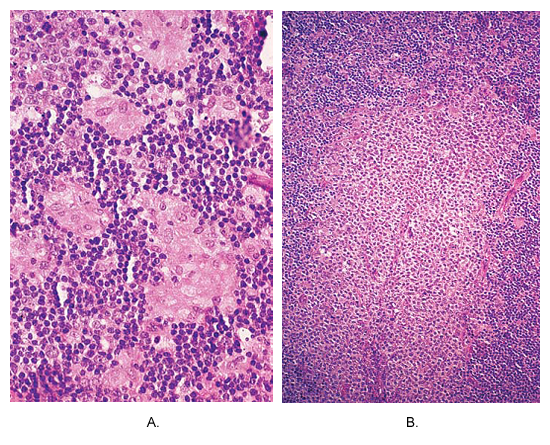
Toxoplasmosis de los ganglios linfáticos. (A) Los pequeños caseosos granulomas compuestos de células epiteliales se encuentran en la periferia del folículo hiperplásico. Esta foto es casi patognomónico de esta enfermedad. (B) una zona de B monocitoides masiva hiperplasia de las células.
El aislamiento de T. gondii de la sangre o fluidos corporales establece que la infección es grave, sin embargo, las pruebas serológicas para la detección de anticuerpos específicos para T. gondii es el principal método de diagnóstico. Después de una infección aguda, los anticuerpos IgM aparecen temprano y llegar a niveles máximos en 1 mes. Los anticuerpos IgG aparecen después de anticuerpos IgM, se detectan en unas pocas semanas después de la infección, y confiere inmunidad. Los títulos elevados de IgG e IgM pueden persistir durante años. En el adulto inmunocompetente, el curso clínico es benigno y autolimitado. IgG e IgM pruebas deben ser utilizados para la evaluación inicial de pacientes con sospecha de toxoplasmosis. Prueba de muestras seriadas 3 semanas de separación, en paralelo permite la evaluación más precisa si los resultados iniciales son equívocos. En los casos en que la sospecha clínica es alta, las muestras deben ser guardadas para repetir la prueba en el laboratorio de referencia, debido a la amplia variación entre los laboratorios.
La detección de la toxoplasmosis durante el embarazo:
Un estudio multicéntrico en los Estados Unidos encontró que aproximadamente el 38% de las mujeres embarazadas tienen evidencia de infección de toxoplasmosis antes de (7). La evidencia de infección anterior significa que la futura madre no está en riesgo de dar a luz a un niño con toxoplasmosis congénita. Tamizaje serológico, como una manera de prevenir la toxoplasmosis congénita tendría el mayor impacto en los países con una alta frecuencia de seropositividad ya los exámenes prenatales de rutina se lleva a cabo en Francia y Austria. Sin embargo, en los Estados Unidos, exámenes de rutina durante el embarazo en la actualidad no es recomendable, excepto en las mujeres infectadas con el virus de la inmunodeficiencia humana (VIH). Tamizaje serológico durante el embarazo puede producir resultados equívocos, ya que los anticuerpos IgM pueden persistir durante largos períodos. Las circunstancias excepcionales pueden justificar la detección título de la toxoplasmosis para las mujeres embarazadas que son dueños de gatos. Un estudio realizado en Bélgica demostró una reducción del 63% en la tasa de infección de toxoplasmosis materna después de la institución de un programa educativo que se recomienda evitar el consumo de carne mal cocida o cruda, con guantes cuando se trabaja con el suelo, y evitar el cuidado de los gatos a menos que sean estrictamente "interior gatos ", cuyo alimento es rígidamente controlada (8).
Perinatal de Evaluación y Seguimiento:
La ecografía puede demostrar la toxoplasmosis congénita severa; hallazgos sugestivos incluyen dilatación ventricular, calcificaciones intracraneales, microcefalia, ascitis, hepatoesplenomegalia, y la restricción del crecimiento intrauterino. Prueba de muestras de sangre fetal después de 20 semanas de gestación para detectar la presencia de IgM específica es la prueba más sensible para el diagnóstico de toxoplasmosis congénita. Uso de la sangre fetal para la prueba de anticuerpos o la inoculación en ratones, el líquido amniótico para PCR, o la ecografía fetal para detectar ventriculomegalia, 77-93% de los niños infectados pueden ser identificados antes de nacer, aunque una sola prueba no es muy sensible (8). La identificación exitosa de T gondii infección intrauterina con la prueba de PCR de líquido amniótico permite anteriores pruebas de que el muestreo de sangre fetal, con una alta sensibilidad, a pesar de falsos positivos y falsos negativos se producen.
Para evaluar la sensibilidad, especificidad y valores predictivos de un líquido amniótico prenatal (AF) la reacción en cadena de la polimerasa (PCR) para el diagnóstico de toxoplasmosis congénita, un estudio prospectivo multicéntrico se realizó en 271 mujeres con infección de toxoplasmosis demostrado primaria durante el embarazo y que tenía la amniocentesis para el diagnóstico prenatal mediante PCR (12). Live-recién nacidos eran elegibles para el análisis sólo si un serológicos de seguimiento podría evaluar un estado de infección por el definitivo.
Resultados: De los 270 casos evaluados, 75 fueron con infección congénita, 48 de los cuales tenían una PCR positiva en el diagnóstico prenatal. La sensibilidad global de la PCR en el AF se estimó en 64% (95% intervalo de confianza [IC] del 53,1%, 74,9%), valor predictivo negativo de 87,8% (IC 95%: 83,5%, 92,1%), mientras que la especificidad y valor predictivo positivo 100% (95% IC del 98%, 100% y 92,3%, 100%, respectivamente). Entre los casos con toxoplasmosis congénita, no hubo diferencias significativas entre aquellos con PCR positiva o negativa con respecto a la edad gestacional media en la infección materna, el intervalo entre la infección materna y la amniocentesis o la duración del tratamiento antes de la amniocentesis. Sin embargo, se encontró la sensibilidad de la PCR a ser significativamente más alta para las infecciones maternas que tuvieron lugar entre el 17 y gestación de 21 semanas (P <.02). Una PCR negativa de la FA no se puede descartar la infección congénita. En este caso, se justifica la continuación del tratamiento con espiramicina combinada con el seguimiento ecográfico y postnatal de seguimiento. Los resultados también sugieren que el tratamiento preventivo combinando pirimetamina y sulfonamidas en caso de infección materna que se presentan en el embarazo.
Crónica o recurrente derivada de la maternidad parasitemia:
Aunque la transmisión congénita de T. gondii se produce en los animales infectados de forma crónica, hace tiempo que se presume que la infección materna primaria con T. gondii tenía que ocurrir durante la gestación, a fin de incluir la concepción. Este concepto ya no es considerada válida. En un estudio de 34 gestantes fueron cultivadas que mostraban evidencia serológica de toxoplasmosis crónica, y cuyo embarazo terminó en aborto, muerte fetal, o muerte neonatal. Los investigadores recuperaron el organismo en dos casos de aborto y en un caso de muerte neonatal (10). Gestantes no tienen que adquirir la infección primaria durante la gestación de transmitir al organismo a la concepción. Parasitemia persistente en este estudio se produjo a pesar de niveles altos de anticuerpos antitoxoplasma. Toxoplasmosis recurrente en pacientes gravemente inmunocomprometidos con CD 4 + recuentos de células T inferiores a 50-100 células / mm 3 es un fenómeno bien documentado. La infección congénita en los hijos sucesivos pueden ocurrir como un caso muy raro. Aunque el riesgo de un bebé infectado segunda parece muy pequeño, sin embargo, existe. Tras el nacimiento de un niño con infección congénita, puede ser prudente para que la madre utiliza algún método anticonceptivo durante al menos un año. La cuestión de si o no para administrar fármacos quimioterapéuticos para la madre es muy controvertida. Si se instaura el tratamiento, es potencial para el feto y no por razones de maternidad.
Efectos sobre el feto y recién nacido:
El T gondii parásito puede atravesar la placenta, en asociación con la infección materna aguda. El organismo puede infectar directamente al feto y se ha vinculado a la muerte fetal esporádica, lo que puede ocurrir en hasta un 5% de los embarazos después de la infección durante el primer trimestre. Sin embargo, la tasa de infección primaria es de aproximadamente 1 por 11.000 en los Estados Unidos (9). Muchos casos de muerte fetal no se sometan a una evaluación adecuada de las posibles causas. Autopsia perinatal placentaria y el examen son, quizás, las pruebas más valiosa para la evaluación de la muerte fetal. La vigilancia prenatal y el apoyo emocional es el pilar de la gestión de embarazo posterior. La importancia relativa de todas las infecciones se ve influida por la prevalencia local de los agentes infecciosos (13). La gravedad de la infección depende de la edad gestacional en el momento de la transmisión. Cuanto antes el feto está infectado, el más grave de la enfermedad. La mayoría de los bebés infectados no presentan signos clínicos de la infección al nacer, pero 55-85% desarrollarán secuelas, incluyendo coriorretinitis - que conducen a un grave deterioro de la visión. Otras manifestaciones clínicas son la pérdida de audición o retraso mental. Rash, hepatoesplenomegalia, ascitis, fiebre, calcificaciones periventriculares, ventriculomegalia, y las convulsiones también se observan en los recién nacidos y los lactantes infectados por toxoplasmosis (9). LA ANTORCHA (serología para toxoplasmosis, rubéola, citomegalovirus y herpes simple) del bebé debido a T gondii suele ser infectados durante el primer trimestre del embarazo. Segundo trimestre la infección fetal más probablemente, los resultados en formes frustradas de la enfermedad, que son más comunes que el síndrome completo. Estas presentaciones clínicas son inexplicables hepatomegalia o hepatoesplenomegalia, coagulopatía intravascular diseminada presente en el nacimiento, o ictericia en las primeras 24 horas de vida. En estos casos, el nivel de IgM sérica tiende a ser mayor de 20 mg / mL; elevación del nivel de IgM es un indicador de crudo de la cronicidad de la infección.
Toxoplasmosis congénita:
La infección congénita puede ocurrir si una mujer desarrolla toxoplasmosis primaria aguda durante el embarazo. Crónica o infección latente es probable que cause daño al feto, salvo tal vez en un paciente inmunodeprimido. Aproximadamente el 40% de los recién nacidos de madres con toxoplasmosis aguda muestran evidencia de infección. La infección congénita es más probable que ocurra cuando la infección materna se desarrolla en el tercer trimestre. Menos de la mitad de los niños afectados son sintomáticos al nacer. Las manifestaciones clínicas de la toxoplasmosis congénita son variadas y se resumen a continuación (7):
- Erupción cutánea;
- Hepatoesplenomegalia;
- Ascitis;
- Fiebre;
- Coriorretinitis;
- Calcificación periventricular;
- Ventriculomegalia;
- Convulsiones;
- El retraso mental;
- Uveítis
Las pruebas más valioso para el diagnóstico prenatal de la toxoplasmosis congénita son la ecografía, cordocentesis, y la amniocentesis. Los hallazgos ecográficos sugestivos de infección incluyen dilatación ventricular, calcificaciones intracraneales, microcefalia, ascitis, hepatoesplenomegalia, y la restricción del crecimiento. De muestras de sangre fetal puede hacerse la prueba de anticuerpos IgM específicos después de la gestación 20 a 22 semanas. De sangre fetal y el líquido amniótico puede ser inoculado en ratones, y el organismo puede ser posteriormente ser recuperados de la sangre de animales infectados. Además, Hohlfeld y otros, han identificado un gen específico de T.gondii en el líquido amniótico mediante PCR (6). En su investigación, 34 de los 339 niños habían toxoplasmosis congénita confirmado por pruebas serológicas o de la autopsia. Todas las muestras de líquido amniótico de embarazos afectados fueron positivos por PCR, y los resultados estuvieron disponibles el plazo de 1 día de la recogida de la muestra. En una investigación posterior, Romand et al (12) informó de que la prueba de PCR mostró una sensibilidad del 64% (intervalo de confianza 95%, 53-75%) para el diagnóstico de toxoplasmosis congénita. No hay resultados falsos positivos fueron observados, y el valor predictivo positivo del 100%.
Gestión en el embarazo:
Toxoplasmosis en el adulto inmunocompetente suele ser asintomática o enfermedad autolimitada y no requiere tratamiento. Está indicado cuando la toxoplasmosis aguda durante el embarazo. El tratamiento de la madre reduce el riesgo de infección congénita y disminuye las secuelas tardías de la infección. El tratamiento de la mujer embarazada con toxoplasmosis aguda reduce pero no elimina el riesgo de infección congénita (13). De identificación de la infección materna aguda requiere apertura inmediata de tratamiento hasta que los resultados de las pruebas fetales son conocidos. Espiramicina, que se concentra en la placenta, pueden reducir el riesgo de transmisión fetal en un 60%, pero como agente único, no se estableció el tratamiento de la infección fetal. Si la infección del feto está establecido; pirimetamina, sulfadiazina y leucovorina (ácido folínico) se añade a la pauta más eficaz, ya que la erradicación de parásitos en la placenta y el feto que la espiramicina sola. Con tratamiento, la infección incluso a principios del feto con toxoplasmosis puede dar lugar a los resultados del embarazo con éxito.
Espiramicina - 1,0 g, po cada 8 horas.
Pirimetamina - 50-100 mg, po dos veces al día en el 1er día, luego a 25 mg una vez al día.
Sulfadiazina - 1-1,5 g, po cada 6 horas
Leucovorina (ácido folínico) - 10 mg o más por día.
El tratamiento se administra durante 1-2 semanas después de la resolución de los signos y síntomas; seguir leucovorina (ácido folínico) 1 semana después de suspender la pirimetamina. Para la toxoplasmosis congénita, toxoplasmosis, la meningitis en adultos y coriorretinitis añadir prednisona 1 mg / kg / día en 2 dosis divididas, hasta que cae la concentración de CSF o amenazan la visión, la inflamación ha desaparecido. Leucovorina (ácido folínico), la dosis se ajusta con los siguientes resultados de CTF (14). Pirimetamina no está recomendado para uso durante el primer trimestre del embarazo debido a la posible teratogenicidad, aunque esto no se ha informado hasta la fecha. Sulfonamidas pueden utilizarse solos, pero la monoterapia parece ser menos eficaz que la terapia de combinación. En Europa, la espiramicina ha sido ampliamente utilizado en el embarazo con excelentes resultados. Está disponible para el tratamiento en los Estados Unidos a través de los Centros para el Control de Enfermedades y Prevención de Enfermedades (CDC).
Recomendaciones de la Organización Mundial de la Salud para la toxoplasmosis aguda durante el embarazo (10):
- Hasta el final de la 20 ª semana de gestación, nueve millones de unidades de la espiramicina son administrados por vía oral diariamente durante 4 semanas. Después de 4 semanas esta pauta se repite.
- Después de 20 semanas de gestación, un curso de 4 semanas de sulfadiazina (1.000 mg / día) en combinación con pirimetamina (25 mg / día) y ácido folínico (10 mg / semana) son administrados. Después de una pausa de 4 semanas a este régimen se repite. Un máximo de tres ciclos de tratamiento se puede producir entre 20 semanas de gestación y el parto.
Pacientes inmunodeprimidos, sin embargo, deben ser tratados, y el régimen de elección es una combinación de sulfadiazina oral (4-g dosis de carga, luego 1 g cuatro veces al día) más pirimetamina (50 a 100 mg inicialmente, luego a 25 mg al día) . En estos pacientes, cursó los cursos de tratamiento puede ser necesario para curar la infección (14).
La quimioterapia está indicada para las personas con formas graves de la toxoplasmosis o alteración inmunológica del mecanismo de defensa del huésped. El tratamiento estándar consiste en adultos de pirimetamina (Daraprim) - 100 mg dos veces al día durante el primer día, seguido de 50 mg al día después, y sulfadiazina - 1,5 g dos veces al día. La combinación de pirimetamina y sulfonamidas es sinérgica contra trofozoítos. La pirimetamina - sulfadiazina - régimen de ácido folínico se alterna cada tres semanas con espiramicina - 3 g al día hasta el parto. No hay ningún tratamiento eficaz actualmente disponible contra la forma enquistada de T gondii. Trombocitopenia, agranulocitosis, anemia megaloblástica pueden desarrollar como consecuencia de la terapia. Levadura de panadero 5-7 g diarios de ácido folínico o de 10-20 mg al día se debe dar al mismo tiempo para evitar la toxicidad hematológica. Las mujeres sometidas a la terapia debe ser seguido muy de cerca con los ensayos de leucocitos, recuento de plaquetas y el hematocrito determinaciones quincenalmente. La administración de pirimetamina puede causar anemia megaloblástica y / o pancitopenia.
Sulfadiazina, puede causar insuficiencia renal secundaria a la cristalización en los túbulos renales y necrólisis epidérmica grave. Las personas que reciben este medicamento necesita beber abundantes líquidos y evitar la deshidratación. Debido a la preocupación de las posibles consecuencias teratogénicos, el fármaco debe evitarse en el primer trimestre, en ausencia de razones imperiosas materna.
Indicaciones para la terapia fetal:
No hay reservas acerca de iniciar el tratamiento para una embarazada asintomático con infección aguda durante la gestación. Las indicaciones de la terapia son los de afectación fetal potencial y no de la derivación materna. Sólo el 25-35% de las mujeres cuya gestación se complica por la toxoplasmosis aguda dará a luz a un recién nacido con infección congénita. En general, la infección materna documentado es una indicación para la terapia, independientemente de los signos y síntomas de la enfermedad sistémica. El enfoque terapéutico está dirigido a tratar de evitar o limitar organísmica futuro la interacción de la célula. El consentimiento informado debe ser obtenido y que establece claramente que la embarazada es consciente no sólo de los problemas potenciales asociados con la terapia de drogas, sino también que no se beneficiará de por sí de la terapia. Debe haber una voluntad por parte de la madre a compartir la responsabilidad de la terapia de drogas. Para la terapia de primera ser retenidos durante el período de organogénesis. Sólo un tercio de los fetos realmente requieren tratamiento, pero el 100% de los fetos serán objeto de exposición al fármaco durante los períodos críticos de la organogénesis. Los europeos abogan por el uso de espiramicina tan pronto como el diagnóstico de la infección materna se ha establecido. Una vez que se haya completado la organogénesis, un régimen de tratamiento utilizando la combinación pirimetamina, sulfadiazina y la espiramicina se lleva a cabo, ya que la espiramicina no fiable atravesar la placenta.
Sulfonamidas debe interrumpirse dos a tres semanas antes de la fecha probable del parto para evitar el problema del antagonismo competitivo con la bilirrubina en el período posparto. Las sulfonamidas competir con éxito con la bilirrubina por el sitio de unión de albúmina. Desplazamiento masivo de la bilirrubina de la albúmina en los sitios de unión puede ser responsable de la inducción de kernicterus en el recién nacido. Las pruebas comparativas han demostrado que sulfapyrazine, sulfametazina y sulfamerazina son tan eficaces como la sulfadiazina. Sulfatiazol, sulfapiridina, sulfadimetine, y sulfisoxazol son mucho menos eficaces y no son recomendables. La dosis habitual de las sulfonamidas sulfadiazina o triple es de 50-100 mg por kg de peso corporal cada 24 horas en dos a cuatro dosis iguales por vía oral.
El tratamiento precoz agresivo de los niños con toxoplasmosis congénita se indica, y consiste en la terapia de combinación (14). El tratamiento de niños con toxoplasmosis congénita sintomática consta de pirimetamina y sulfadiazina, alternando con espiramicina mensuales, durante 1 año. El tratamiento disminuir o resolver las calcificaciones intracraneales si está presente, lo que sugiere mejorar la función neurológica. El tratamiento precoz reduce pero no elimina, las secuelas tardías de la toxoplasmosis, como coriorretinitis.
Prevención:
La infección por Toxoplasma de la mujer embarazada se puede prevenir. Esto se logra evitar la ingestión de quistes u ooquistes esporulados de la mujer seronegativa. Los quistes son convertidos en no infecciosos por la carne de calefacción a 66 º C o por fumar o curarla. La congelación es menos fiable, ya que requiere de temperatura (-20 º C) no se logra por la mayoría de los congeladores de casa. Las frutas y verduras crudas deben lavarse minuciosamente y las medidas concretas adoptadas para impedir el acceso a las moscas, cucarachas y otros insectos a las heces de los animales. Las manos deben lavarse cuidadosamente después de tocar carne cruda o verduras. El manejo de las heces de gato debe evitarse por completo. Si esto no es posible, guantes desechables deben ser usados cuando la eliminación de los desechos de gatos y al cultivar un huerto en el exterior. El tratamiento de la arena para gatos perfectamente sartén con agua hirviendo durante cinco minutos va a matar ooquistes potencialmente infecciosos. En un reciente estudio de los factores de riesgo, el contacto frecuente con el suelo puede ser más importante un riesgo para la infección materna que la presencia de un gato doméstico. Los elementos clave en la prevención de la toxoplasmosis materna incluyen amartillar carne hasta que esté bien hecho, lavar las frutas y hortalizas y el uso de guantes cuando se trabaja en el jardín (si los gatos con frecuencia la zona) o la eliminación de arena para gatos (15). No hay medicamentos para eliminar los quistes de tejido T gondii en los tejidos humanos o animales. De la congelación a -20 º C, cocinar a una temperatura interna de 66 º C, o la irradiación de rayos gamma (0,5 kGy) puede matar a los quistes de los tejidos en la carne.
Resumen:
Un control serológico de rutina para toxoplasmosis es probable que no sea rentable, sin embargo, la selección limitada de las gestantes a quienes les gusta cruda o carne poco cocida, que tienen un contacto significativo con animales o que se aboga por hacer extensiva la jardinería. Anticuerpos IgG específicos estarán presentes en un número significativo de estos pacientes. Sólo aquellas gestantes con sífilis congénita, concomitante IgM específica necesidad de evaluación y de gestión. Todas las gestantes que están con problemas de inmunidad o inmunodeprimidos deben ser examinados para detectar la presencia de anticuerpos anti-toxoplasma. Las mujeres seropositivas deben ser monitorizados cuidadosamente para la reactivación potencial de la enfermedad. Un estudio multicéntrico en los Estados Unidos ha descubierto que aproximadamente el 38% de las mujeres embarazadas tienen evidencia de infección de toxoplasmosis antes. La evidencia de infección anterior significa que la futura madre no está en riesgo de dar a luz a un niño con toxoplasmosis congénita. En los Estados Unidos, exámenes de rutina durante el embarazo en la actualidad no es recomendable, excepto en las mujeres infectadas con el virus de la inmunodeficiencia humana (VIH). Las mujeres embarazadas que adquieren la toxoplasmosis debe ser tratada con espiramicina. Cuando se diagnostica, la toxoplasmosis fetal debe ser tratado con una combinación de pirimetamina, sulfadiazina y ácido folínico, alternando con espiramicina. El diagnóstico de toxoplasmosis debe ser confirmado por un laboratorio de referencia fiable.
Lecturas recomendadas:
- World Health Organization
Report of the WHO Working Group meeting on Toxoplasmosis Vaccine Development and Technology - US Department of Health and Human Services; National Toxicology Program
Toxoplasmosis - Center for Disease Control and Prevention
Toxoplasmosis and Pregnancy - Facts and Prevention
Referencias:
- Stray-Pedersen B. Toxoplasmosis in Pregnancy. Baillieres Clin Obstet Gynaecol 1993;7:107-137 (Level III)
- Levine EM. Risk factors for Toxoplasma gondii infection in mothers of infants with congenital toxoplasmosis: Implications for prenatal management and screening. Am J Obstet Gynecol 2006;194:589
- Egerman RS, Beazley D. Toxoplasmosis. Semin Perinatol 1998;22:332-338
- Lymph nodes. In Surgical Pathology; 9th edition. Editors: Rosai and Ackerman 2004. Publisher Mosby
- Hohlfeld P, Daffos F, Costa JM, et al. Prenatal diagnosis of congenital toxoplasmosis with a polymerase-chain-reaction test on amniotic fluid. N Engl J Med 1994;331:695-699 (Level II-2)
- Sever JL, Ellenberg H, Ley AC et al. Toxoplasmosis: maternal and pediatric findings in 23,000 pregnancies. Pediatrics 1988;82:181-192 (Level II-3)
- ACOG Practice Bulletin. Perinatal viral and parasitic infections. Number 20, September 2000
- Hill D, Dubey JP. Toxoplasmosis gondii: transmission, diagnosis and prevention. Clin Microbial Infect 2002;8:3-634-640
- Toxoplasma gondii. In Infectious diseases in obstetrics and gynecology; 5th edition. Editors: Monif GG, Baker DA; Parthenon publishing, 2004
- Bastien P. Molecular diagnosis of toxoplasmosis. Trans R Soc Trop Med Hyg 2002;96:S205-215
- Romand S, Wallon M, Franck J et al. Prenatal diagnosis using polymerase reaction on amniotic fluid for congenital toxoplasmosis. Obstet Gynecol 2001;97(2):296-300
- Goldenberg RL, Thompson C. The infectious origins of still birth. Am J Obstet Gynecol 2003;189:861-873
- Silver RM. Fetal Death. Obstet Gynecol 2007;109:153-167
- Duff P. Maternal and perinatal infections. In Obstetrics: Normal and Problem Pregnancies; 5th edition. Eds: Gabbe SG, Niebyl JR, Simpson JL. Publisher: Churchill Livingstone Elsevier; 2007
- Dean V, Coonrod BW, Jack PG et al. The clinical content of preconception care: infectious diseases in preconception care. Am J Obstet Gynecol 2008;199:S296-S309
Publicado: 3 September 2009
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


