Mort-né: évaluation et gestion
Bulletin WHEC pratique et directives cliniques de gestion pour les fournisseurs de soins de santé. Subvention à l'éducation fournie par la santé des femmes et Education Center (WHEC).
Mortinaissance est l'une des complications les plus dévastatrices, ainsi que obstétricales, commune, affectant plus de 3 millions de grossesses par an dans le monde (1) . Une question majeure en suspens est l'évaluation diagnostique optimal pour les cas de mortinaissance. Importants problèmes psychologiques et émotionnels surgissent lorsqu'il s'agit d'une grossesse résultant d'un enfant mort-né. En couple éprouvent souvent des sentiments d'anxiété, de l'échec, de culpabilité personnelle, et d'appréhension au moment d'envisager une grossesse après avoir eu un enfant mort-né. Beaucoup de femmes ne reçoivent des conseils complets sur la cause de la mortinaissance, car une évaluation incomplète a été réalisée, et dans 50% des cas, la cause reste inconnue. Il est difficile pour les cliniciens de consulter un avocat, d'évaluer et de gérer les grossesses ultérieures de manière optimale car on sait très peu sur les résultats de la grossesse après une mortinaissance. Il ya plusieurs raisons pour lesquelles il peut être difficile de déterminer une «cause» de mortinaissance. Tout d'abord, la cause de la mortinaissance peut être complexe et multifactorielle. Plusieurs conditions simultanées peuvent contribuer à une mortinaissance donné et il ne sera pas possible de déterminer une seule cause immédiate. Deuxièmement, de nombreuses conditions sont des «facteurs de risque» plutôt que les causes de mortinaissance. Ces conditions sont souvent présents dans les grossesses naissances vivantes. Les exemples incluent le tabagisme, l'obésité ou le diabète bien contrôlé. Troisièmement, une cause de mort ne peut être identifié, même après une évaluation approfondie de mortinaissance. Enfin, il ya des causes probables de la mort à la naissance n'ont pas encore été découverts.
Le but de ce document est d'examiner l'information à jour sur la mortinatalité, y compris les définitions et la gestion, l'évaluation d'un enfant mort-né, et les stratégies de prévention. Il ya un manque d'information sur l'issue des grossesses après la mortinaissance. Avant de mortinatalité est associée à un risque 2 fois à 10 fois plus élevé de mortinatalité dans le future grossesse. Le risque dépend de l'étiologie de la mortinatalité avant, la présence d'une restriction de croissance ftale, l'âge gestationnel de l'enfant mort-né avant, et la race. La mortinatalité terme est préféré parmi les groupes de parents, et les efforts de recherche les plus récents ont commencé à utiliser ce terme à la place de la mort du ftus. Par conséquent, dans le présent document, le terme est utilisé mortinatalité. Il faut souligner que les critères de mortinatalité n'impliquent pas un point de la viabilité et ont été choisis pour faciliter la collecte de données uniforme. Aux États-Unis, les pertes ftales liées à l'interruption de grossesse pour anomalie ftale létale et les inductions de travail pour rupture prématurée des membranes previable sont spécifiquement exclus des statistiques de la mortinatalité et sont classés comme une interruption de grossesse.
Épidémiologie de la mortinatalité
Mortinaissance est l'un des résultats les plus courantes défavorables de la grossesse aux États-Unis, se produisant dans un cas sur 200 grossesses, ce qui équivaut à environ 26.000 enfants mort-nés chaque année (2) . Le taux de mortinatalité aux États-Unis a légèrement diminué au cours des 15 dernières années, avec un taux de 6,2 pour 1000 naissances vivantes en 2003 (2). C'est près de 1 sur 160 grossesses. La diminution de la mortinatalité a surtout été mis en mort-nés après 28 semaines de gestation. De nombreux enfants mort-nés à des causes génétiques. Il s'agit notamment de l'aneuploïdie, des syndromes, des malformations, et un seul gène (y compris mendélienne) troubles. Mort-nés représentent la moitié de tous les décès périnataux, et 50% ont une cause indéterminée de la mort. Il est important disparités raciales dans les taux de mortinatalité et le taux de non-hispaniques femmes noires est plus du double de celui des femmes non hispaniques blancs (2).
Le taux de mortinatalité a considérablement diminué depuis les années 1950 (20 pour 1.000 naissances) dans les années 1980 avec l'amélioration des soins pour des affections telles que le diabète, l'allo-immunisation érythrocytaire, et la pré-éclampsie. Cependant, les taux de mortinatalité ont été relativement stables au cours des 20 dernières années, atteignant un plateau aux États-Unis. Depuis 1990, le taux de mortinatalité précoce (20-27 semaines), est resté stable à environ 3,2 pour 1000 naissances, tandis que le taux de mortinaissances tardives (28 semaines ou plus) a diminué de 4,3 à 3,1 pour 1000 naissances. En 2004, le taux de mortinatalité aux États-Unis était de 6,2 pour 1000 contre 6,4 pour 1000 naissances en 2002 (2). Dans les pays développés, les facteurs de risque les plus fréquents associés à la mortinatalité sont non-hispaniques race noire, la nulliparité, l'âge maternel avancé, et l'obésité. Du point de vue de la santé publique, l'utilisation obésité, le tabagisme, la toxicomanie et l'alcool sont communs potentiellement facteurs de risque modifiables pour le résultat défavorable de la grossesse. En 2001, les Afro-Américains a subi un taux de mortinatalité de 12,1 pour 1000 naissances contre 5,5 pour 1000 pour les Blancs (3).
Définition
Définitions de la mortinaissance (et donc les taux de mortinatalité) varient selon les pays, en fonction de l'âge gestationnel. Aux États-Unis, la mortinaissance (définie comme le décès du ftus à l'âge gestationnel> 20 semaines) touche environ 1 dans 160 grossesses (6-7 pour 1.000 naissances). Le taux est similaire dans la plupart des pays à revenu élevé (3-5 pour 1000 naissances), mais est nettement plus élevé (20-100 pour 1000 naissances) dans les pays à faible et moyen revenu (1). Le United States National Center for Health Statistics définit morts foetales (mortinaissances) que la livraison d'un foetus montrant aucun signe de vie, comme indiqué par l'absence de respiration, les battements cardiaques, la pulsation du cordon ombilical ou des mouvements précis des muscles volontaires (4). Il n'y a pas une uniformité totale entre les États en ce qui concerne le poids de naissance et l'âge gestationnel critères pour rendre compte des morts ftales. Cependant, l'exigence proposée consiste à rapporter la mort ftale à 20 semaines ou plus de gestation (si l'âge gestationnel est connu), ou un poids supérieur ou égal à 350 grammes si l'âge gestationnel est inconnu. Le seuil de 350 grammes est le 50e percentile pour le poids à 20 semaines de gestation.
Classification de mortinaissance
Dans de nombreux cas, il est difficile d'être certain de l'étiologie de la mort à la naissance. Tout d'abord, de nombreux cas sont inexpliqués, malgré une enquête approfondie des causes potentielles. Deuxièmement, plusieurs conditions peuvent contribuer à la mortinaissance dans un cas particulier. Par exemple, l'infection peut se produire chez un ftus atteint de trisomie 18. Il n'est pas possible de déterminer avec précision quel trouble était directement responsable de la perte. En effet, il est probable que certains cas de mortinaissance sont dues à des contributions de plusieurs facteurs. Enfin, les conditions peuvent être associées à une mortinaissance sans en faire directement la cause. Ces préoccupations ont conduit au développement de plusieurs systèmes de classification des causes de mortinaissance. Aucun système de classification unique est universellement accepté, et chacun a ses forces et ses faiblesses. En 1980 Wigglesworth et collaborateurs introduit le système 9 catégorie de classification qui est actuellement le plus couramment utilisé dans les rapports de mortalité périnatale (5).
I. Wigglesworth Classification:
- Congénitale / malformation (mortel ou grave);
- Antepartum mort ftale inexpliquée;
- La mort de l'asphyxie intrapartum, l'anoxie, ou d'un traumatisme;
- Immaturité;
- Infection;
- Décès dus à d'autres causes spécifiques;
- Mort subite du nourrisson, cause inconnue;
- Inclassable.
Gardosi et al récemment proposé une nouvelle classification dans laquelle sont exclus les décès néonatals (6). Bien que cette classification indique le codage des primaires et secondaires «causes» de la mortinatalité, l'objectif est d'identifier les conditions pertinentes présents au moment de la mort in utero. Il s'agit d'une classification hiérarchique dans laquelle la hiérarchie commence à partir des conditions qui affectent directement le ftus et se déplace vers l'extérieur dans les groupes anatomiques. Les auteurs ont démontré une diminution significative de la mortinaissance, non classés par rapport à la classification Wigglesworth. Ces auteurs soulignent l'importante contribution de restriction de croissance ftale, avec environ 50% de la mortinatalité associée à la restriction de croissance ftale.
II. ReCoDe (condition pertinente de la mort) Classification:
- Ftus: anomalie congénitale mortelle, l'infection chronique, (par exemple, * TORCH), aiguë; anasarque non immune; isoimmunization; hémorragie foeto-maternelle, double-twin transfusion; asphyxie intrapartum; restriction de croissance ftale; autre.
- Cordon ombilical: prolapsus; boucle constriction ou d'un noeud; insertion vélamenteuse; autre.
- Placenta: décollement; praevia; vasa praevia; infarctus placentaire; autre insuffisance placentaire; autre.
- Liquide amniotique: chorioamniotite; oligoamnios; hydramnios; autre.
- Utérus: rupture; anomalies utérines; autres.
- Mère: diabète, maladie de la thyroïde, hypertension essentielle, les maladies hypertensives de la grossesse; lupus / syndrome des antiphospholipides; cholestase, l'abus de drogues; autre.
- Trauma: externe; iatrogène.
- Non classés: aucune condition pertinente identifiée; aucune information disponible.
*TORCH: toxoplasmose, d'autres infections, la rubéole, le cytomégalovirus et l'herpès simplex virus
Facteurs de risque
Conformément facteurs démographiques pour la mortinatalité sont la race, le statut socio-économique bas, insuffisance des soins prénatals, moins d'éducation, et l'âge avancé de la mère (7). Femmes afro-américaines ont des taux de mortinatalité qui sont plus de deux fois le taux pour les mères blanches. En partie, cela peut être dû à des facteurs de risques secondaires tels que le statut socio-économique et le manque de soins prénatals.
Fréquemment signalés facteurs de risque maternels et causes de mortinaissance (8):
| Pays les moins avancés | Les pays en développement |
| Les anomalies congénitales et caryotypique; | Obstrué et prolongé du travail et associé asphyxie, une infection, une blessure et la naissance; |
| Restriction de la croissance et des anomalies placentaires; | Infection notamment la syphilis et les infections à Gram négatif; |
| Maladies comme le diabète, le lupus érythémateux disséminé, une maladie rénale, maladie de la thyroïde, et une cholestase de la grossesse; | Maladies hypertensives et les complications de la prééclampsie et de l'éclampsie; |
| Hypertension et de maladies pré-éclampsie; | Les anomalies congénitales; |
| Infection, tels que le parvovirus humain 19, la syphilis, l'infection streptococcique, et la listeria; | Un mauvais état nutritionnel; |
| Le tabagisme; | Le paludisme; |
| Grossesse multiple; | Drépanocytose |
Les anomalies chromosomiques et génétiques
Un caryotype anormal peut être trouvée dans environ 8-13% de mortinaissances (9). Le taux d'anomalies chromosomiques est supérieure à 20% chez les ftus présentant des anomalies anatomiques ou dans ceux qui ont un retard de croissance, mais le taux d'anomalies chromosomiques chez les ftus trouvés normalement formés a été trouvé à 4,6% dans une série importante (9). Si un caryotype anormal est trouvé en association avec la mortinatalité, les anomalies les plus fréquentes sont la monosomie X (23%), la trisomie 21 (23%), la trisomie 18 (21%), et la trisomie 13 (8%). Mosaïcisme placentaire confiné a également été associée à un risque accru de mortinatalité, mais ne fait pas partie de l'essai standard (10). Analyse caryotypique sous-estime la contribution des anomalies génétiques à la mortinaissance, car dans 50% des tentatives de culture de cellules caryotype a échoué (10). Une stratégie visant à augmenter le rendement de la culture cellulaire est de réaliser une amniocentèse avant la livraison. Cette opération est généralement effectuée après que la femme a eu l'occasion de traiter la mort de son bébé et après une péridurale est placé. Dans une vaste étude hollandaise, des tests invasifs a un taux beaucoup plus élevé de culture tissulaire (85%) que l'échantillonnage des tissus ftaux après la naissance (28%). En outre, des évaluations de routine pour les maladies monogéniques et microdélétions ne sont actuellement pas recommandée en raison de l'incertitude sur le rôle de ces anomalies génétiques. Cependant, il est probable qu'aucun défaut un seul gène est susceptible d'être responsables d'une proportion importante de mortinaissance. L'évaluation génétique des anomalies spécifiques devraient être guidés par l'histoire clinique et détecté des anomalies foetales. Environ 20% des ftus mort-nés présentent des caractéristiques dysmorphiques ou des anomalies du squelette et 15-20% a une malformation majeure (11).
Malformations congénitales
Même si certains ont recommandé que l'évaluation approfondie postnatale du ftus être effectuée que dans certains cas, la fréquence des résultats inattendus et imprévus est l'argument de la routine, l'évaluation globale de toutes les mortinaissances (12). En utilisant une telle approche, environ 20% des mort-nés auront détectables anomalies congénitales du ftus en tant que causes de décès. Une malformation peut être considéré comme la cause de décès selon des critères spécifiques; remplir l'une des conditions suivantes est suffisante pour postulat qu'un processus particulier est causale:
- Il existe des données épidémiologiques démontrant un excès de mortalité intra-utérine (par exemple, syndrome de Turner, le syndrome de Down, la trisomie 18, et Smith Lemli Optiz Syndrome).
- Le processus est rarement observée chez les nouveau-nés nés vivants (par exemple, la baisse des défauts mésodermiques, triploïdie et la perturbation amnios début).
- Lorsque le processus est vu dans les nouveau-nés nés vivants, il en résulte souvent dans la mortalité néonatale (anencéphalie, une cardiomyopathie congénitale, hydranencéphalie, et des membres du corps séquence perturbation mur).
- Il est plausibilité biologique qu'il peut entraîner la mort (aprosencephaly, le syndrome de Meckel, et la séquence d'obstruction jugulolymphatic).
Si plusieurs critères sont remplis, la probabilité que le processus a causé la mort est augmentée.
Âge de la mère plus de 35 ans
Âge de la mère est associée à un risque accru de mortinatalité chez les femmes nullipares et les multipares (13). Une proportion importante des décès périnatals vu chez les femmes âgées sont liées à des anomalies congénitales létales et chromosomiques. L'introduction de la population basée sur le dépistage des anomalies chromosomiques a contribué à la baisse des taux de ce type de mort périnatale. Études à grande échelle suggèrent qu'un risque accru de mortinatalité inexpliquée en fin de grossesse chez les femmes âgées persiste, même après contrôle des facteurs de risque tels que l'hypertension, le diabète, le placenta praevia, et de grossesses multiples (13), (14). En outre, il semble y avoir une interaction entre la première naissance et l'âge avancé de la mère qui met primiprous femmes âgées à un risque accru (13). Basé sur une étude, le risque estimé de mortinatalité est de 1 sur 116 en une femme de 40 ans, nullipare après 37 semaines de gestation, contre 1 sur 304 dans une femme multipare du même âge (13).
Infection
L'infection a été associée à 10% à 25% des mort-nés dans les pays développés (15). Le pourcentage est beaucoup plus élevé dans les pays en développement. L'infection peut conduire à la mortinaissance dans une variété de façons. Il s'agit notamment de l'infection ftale directe avec des dommages à un organe vital, la déformation du ftus, l'infection placentaire conduisant à la fonction placentaire avec facultés affaiblies, une grave infection maternelle systémique conduisant à une septicémie, et infection menant à travail prématuré à mort ftale intra-partum. Il peut être difficile de déterminer si une mortinaissance est le résultat d'une infection parce que certains organismes sont présents chez les femmes en bonne santé qui ont des grossesses normales. La prudence est recommandée avant de supposer que l'infection est une cause de la mortinaissance.
Les infections bactériennes: de nombreuses bactéries ont été impliqués comme causes de mortinaissance. Beaucoup d'entre eux sont flore vaginale qui atteint le tractus génital supérieur à travers le col de l'utérus. Ils peuvent infecter les deciduas et chorion, pour finalement atteindre le ftus à travers le liquide amniotique. Ces organismes comprennent Escherichia coli, Klebsiella, groupe B Streptococcus hominus Mycoplasma, Ureaplasma urealyticum, et Bacteroides espèces. Rarement, des bactéries telles que Listeria monocytogenes peuvent atteindre le ftus par voie hématogène. Certains de ces organismes peut provoquer cliniquement apparente infection intra-amniotique de la fièvre, des douleurs abdominales, et les contractions utérines. Cependant, les symptômes peuvent être vagues, rendant le diagnostic difficile, surtout dans les cas d'infection par des organismes relativement indolores comme mycoplasmes, uréaplasmes et Listeria .
Les infections virales: l'infection virale la plus fréquente est le cytomégalovirus (CMV). Infection ftale est habituellement associée à une infection maternelle primaire, ce qui se produit dans environ 1% des grossesses aux États-Unis (16). Bien que de nombreux ftus infectés par le CMV souffrir d'effets indésirables, la mortinaissance est rare. Parce que l'infection à CMV ftale est fréquente, et la plupart des nourrissons survivent, la preuve histologique du CMV chez le foetus et le placenta doit être présent si mortinatalité est à imputer à CMV. Le parvovirus B19 est le plus souvent liée à la perte de grossesse. Le virus attaque les précurseurs des érythrocytes et des cellules du myocarde, entraînant une anémie, une dysfonction myocardique, l'anasarque et dans les cas graves, la mortinaissance. Le parvovirus B19 a été signalé à être présent dans 7,5% des morts ftales dans une étude suédoise qui a utilisé la réaction en chaîne par polymérase pour évaluer l'infection (17). De nombreux autres virus ont été associés à la mortinatalité sporadiques. Coxsackie virus A et B peut causer une inflammation du placenta, la myocardite, l'anasarque, et la mort. D'autres virus sont les adénovirus, les échovirus, entérovirus, la varicelle, la rubéole (rougeole), les oreillons et la rubéole. Le risque de mortinatalité en association avec certains de ces virus peut être grandement réduit par la vaccination. Le virus de l'immunodéficience humaine (VIH) peut infecter le ftus in utero, mais provoque rarement une mortinaissance. En revanche, les herpès simplex virus infecte rarement, mais peut causer des mort-né.
Autres infections: il ya plusieurs causes infectieuses communes de mortinatalité, y compris les spirochètes, les parasites, et d'autres types d'organismes. La syphilis, causée par Treponema pallidum , est associée à une mortinaissance. Le spirochète peut traverser le placenta dans la dernière partie de la grossesse. Mort-né peut se produire soit à cause de l'infection ftale directe ou inflammation du placenta et la vasculopathie en réponse à l'infection placentaire. Le risque de mortinatalité en raison des hausses de syphilis avec l'âge gestationnel. Treponema pallidum provoque encore mort-nés occasionnels aux États-Unis, avec un taux de syphilis congénitale d'environ 10 pour 100.000 habitants (18). Il est beaucoup plus fréquent dans certaines régions endémiques, comme le delta du Mississippi, les zones urbaines défavorisées et les régions frontalières des États-Unis du Mexique, ainsi que dans les pays en voie de développement avec une prévalence plus élevée de ces conditions. D'autres spirochètes comme Borrelia burgdorferi , l'agent causal de la maladie de Lyme, produire des mortinaissances sporadiques. Toxoplasma gondii est un parasite transmis par la viande insuffisamment cuite ou par les excréments de chat. Il peut traverser le placenta après l'infection maternelle, ce qui conduit à l'infection du ftus et de la mort. Infection ftale survient dans environ 40% des cas et est plus susceptible tard dans la gestation (19). Cependant, les conséquences de l'infection ftale sont plus graves tôt dans la grossesse. On estime que 5% des infections ftales entre 10 et fait 24 semaines de gestation à des problèmes graves, y compris la mort (19). Toxoplasma gondii est rare aux Etats-Unis (environ 1 pour 1000), et il est probable une cause rare d' enfant mort-né (15). La prévalence est beaucoup plus élevée dans d'autres pays.
Les infections systémiques: L'infection maternelle sévère systémique peut aussi conduire à la mortinaissance. La plupart des infections systémiques sont bien tolérés par le ftus. Cependant, la septicémie peut conduire à une ischémie utérine et une diminution de la perfusion placentaire, ce qui entraîne une mortinaissance avant l'accouchement. Alternativement, l'infection systémique déclenche parfois le travail prématuré et de livraison. En particulier dans le cadre d'un enfant previable, cela peut causer un décès intrapartum.
Évaluation d'une mortinaissance
Les tests les plus importants dans l'évaluation d'un enfant mort-né sont autopsie ftale; examen du placenta, du cordon ombilical et les membranes et l'évaluation caryotype. En plus de l'identification des anomalies congénitales et des anomalies morphologiques suggérant des anomalies génétiques ou de développement, l'autopsie permet de déterminer et / ou confirmer de nombreuses autres causes de mortinaissance. Il est utile de demander aux familles de leurs préoccupations spécifiques et les raisons du refus d'autopsie. Dans de nombreux cas, leurs craintes peuvent être soulagés par l'éducation ou la modification de la procédure. Dans les cas où une autopsie est refusée, partielle autopsie ou post-partum imagerie par résonance magnétique (IRM) peut fournir des informations importantes (20). Quand une autopsie complète est réalisée, elle devrait suivre les lignes directrices publiées pour autopsie périnatale. Le pathologiste doit être au courant de l'histoire clinique et les diagnostics génétiques présumés, ainsi que toute collecte de tissus nécessaires qui doivent être effectués pour des analyses supplémentaires. Un algorithme d'évaluation est donnée ci-dessous (11).
Organigramme pour l'évaluation du ftus et du placenta (11):
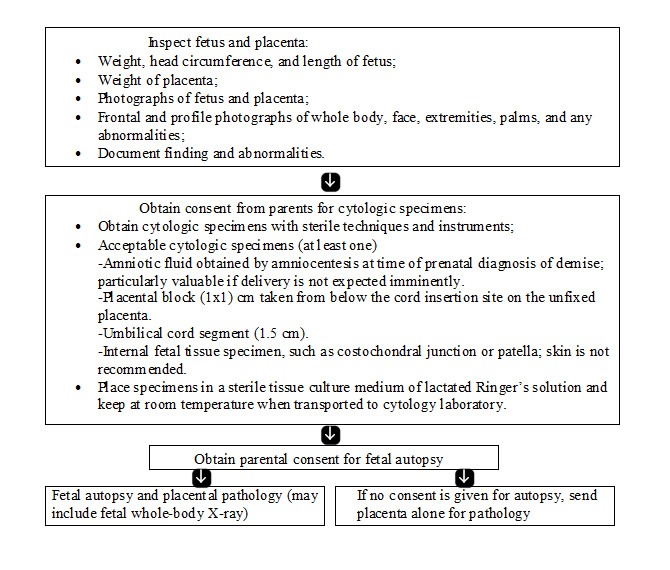
Alternatives à une autopsie complète
L'examen macroscopique et microscopique du placenta est un élément essentiel de l'évaluation de tout enfant mort-né et devrait inclure un examen des membranes et le cordon ombilical qui peuvent corroborer les résultats d'autopsie. Même si la famille refuse l'autopsie ftale, l'étude histologique du placenta est habituellement acceptable et peuvent être utiles pour identifier les causes sous-jacentes.
- L'examen du placenta et de l'examen externe par pathologiste périnatal (inclut généralement les mesures du bébé, les radiographies et les photographies). Il aura plus de chances d'identifier les syndromes, anomalie congénitale, et le moment de la mort ainsi que des anomalies de croissance. Il sera capable de détecter des infections placentaires et de la moelle. Il peut manquer des infections ftales et le système interne congénitale et nerveux central (SNC) des anomalies.
- L'examen du placenta et de l'examen externe par un pathologiste périnatal et les biopsies sélectionnés (ce qui inclut généralement des mesures du bébé, les radiographies et photographies). C'est peut-être plus de chances d'identifier les infections ftales, ses limites sont indiquées ci-dessus.
- L'examen macroscopique et microscopique du placenta et de l'examen externe et interne du ftus par un pathologiste périnatal, les organes, sont laissés avec le corps et le cerveau n'est pas examinée (ce qui inclut généralement des mesures du bébé, les radiographies et photographies). Il permet au bébé d'être remis à la famille avec tous les organes. Il va manquer SNC pathologie, mais permet de détecter des anomalies congénitales internes et être en mesure d'évaluer le rôle de l'infection.
- Chef épargnant autopsie. Il a des avantages d'autopsie complète; peut manquer certains SNC pathologie.
- Imagerie par résonance magnétique (IRM) avec plus ou moins dirigé biopsie à l'aiguille. Il peut être très utile avec la famille nécessite tombe intacte en temps opportun. L'IRM est bonne dans l'identification de la pathologie du système nerveux central, mais d'autres anomalies telles que des anomalies cardiaques sont plus susceptibles d'être manquée. Infections ne sera pas diagnostiquée à moins biopsies supplémentaires sont pris en considération. Cette stratégie n'a pas été comparé à l'autopsie traditionnelle.
- Échographie. Il est préférable de faire in utero, mais peut être fait après la naissance. La tête, les reins, ou de l'abdomen peut être évaluée, mais seulement des images statiques du cur peut être vu. Il n'est pas aussi bon que l'IRM pour le cerveau, mais peut-être en mesure de fournir des informations utiles si une précédente étude radiologique du foetus n'a pas été effectuée. Elle est limitée par le degré de macération, et ne pas évaluer le rôle de l'infection dans la mort du ftus.
Les études de laboratoire sur le ftus
Caryotype ftal est précieuse, surtout dans les cas où l'autopsie n'est pas effectuée. Anomalies chromosomiques sont présents dans au moins 6 à 12% de mort-nés (21). Le risque d'un caryotype anormal est plus élevé pour les ftus présentant des anomalies structurelles, de traits dysmorphiques ou ceux mourir plus tôt dans la gestation. Ces facteurs de risque peuvent être utilisées pour stratifier le risque si le coût est un problème. Tissus les plus susceptibles de fournir des cellules qui peuvent être cultivées avec succès dans la culture comprennent le placenta (plaque chorionique en particulier), le fascia lata, la peau de la nuque et les tendons. Idéalement, un pathologiste qualifié doit envoyer tissus pour le caryotype après évaluation grossière du ftus et du placenta. Si cela n'est pas possible, les cliniciens doivent prendre soin de ne pas placer les tissus placentaires ou ftaux dans le formol sorte que les tentatives peuvent être faites pour des cellules en culture. L'hybridation génomique comparative montre très prometteuse pour l'identification des anomalies chromosomiques dans les cellules ftales dans laquelle mortinaissances ne peut pas être cultivée avec succès (22). En cas d'échec de culture cellulaire, les cliniciens doivent déterminer si l'hybridation génomique comparative est disponible dans leur centre. Des anomalies génétiques non identifiés par caryotype presque assurément contribuer à certains cas de mortinaissance. Autres tests génétiques pour des maladies spécifiques peuvent être appropriées fondées sur des soupçons soulevé par l'autopsie périnatale. Cependant, le test généralisé pour des maladies monogéniques, microdélétions, et mosaïcisme placentaire confiné est encore considéré comme expérimental et la preuve d'offrir ces tests sur une base régulière est absente. Caryotype ftal est également important si un des parents est porteur d'un réarrangement chromosomique équilibrée (translocation ou inversion par exemple) ou a un caryotype mosaïque. Des échantillons de liquide amniotique, le cordon ombilical, les tissus ftaux, ou le placenta peut être obtenue pour chromosomiques et tout autres tests pertinents. L'amniocentèse pour caryotype ftal a le rendement le plus élevé et est particulièrement utile si la livraison ne devrait pas imminente (9).
Évaluation de la mère
Une histoire complète de la mère doivent être prises à la recherche de conditions connues ou des symptômes évocateurs de ceux qui ont été associés à la mortinaissance. Les composants et les éléments clés de l'histoire de la mortinatalité et de l'évaluation sont les suivants:
- Antécédents familiaux: avortements spontanés récurrents; thrombo-embolie veineuse ou d'embolie pulmonaire; anomalie congénitale ou caryotype anormal; affection héréditaire ou syndrome; retards de développement et de consanguinité.
- Antécédents maternels: thromboembolie veineuse ou d'embolie pulmonaire avant, diabète sucré, l'hypertension chronique, thrombophilie, le lupus érythémateux disséminé, une maladie auto-immune, l'épilepsie, l'anémie sévère, les maladies cardiaques, le tabac, l'alcool, la drogue ou l'abus de médicaments.
- Antécédents obstétricaux: fausses couches à répétition, l'enfant précédent avec anomalie héréditaire, ou une restriction de croissance; précédente hypertension gestationnelle ou la prééclampsie; précédente diabète gestationnel; précédente décollement placentaire; précédent la mort ftale.
- Grossesse en cours: l'âge maternel, l'âge gestationnel au moment de la mort du ftus, les conditions médicales compliquant la grossesse (par exemple l'hypertension, le diabète sucré, le lupus érythémateux systémique, la cholestase), gain de poids pendant la grossesse et l'indice de masse corporelle, de complications de la grossesse multifetal, comme le syndrome de transfusion jumeau jumeau , double inversé syndrome de perfusion artérielle, et la croissance discordante; décollement placentaire; traumatisme abdominal, le travail prématuré ou de rupture des membranes, l'âge gestationnel au moment de l'apparition des soins prénatals; anomalies observées sur une image échographique, les infections ou chorioamniotite.
- L'évaluation de la mère au moment de la disparition: numération formule sanguine complète, écran hémorragie fto-maternelle: Kliehauer-Betke ou un test comparable pour les cellules ftales dans la circulation maternelle; immunoglobuline G humaine par le parvovirus B19 et anticorps immunoglobuline M, la syphilis; anticoagulant lupique; anticorps anticardiolipine, la thyroïde l'hormone de stimulation; thrombophilie (dans des cas sélectionnés) - facteur V Leiden, mutation du gène de la prothrombine, l'antithrombine III, l'homocystéine à jeun.
- Post-partum: la protéine S et la protéine C l'activité (dans des cas sélectionnés); caryotype parental (le cas échéant); test de Coombs indirect; dépistage de la glycémie (test oral de tolérance au glucose, hémoglobine A1C); écran toxicologie. Dans des cas sélectionnés de test d'anticorps antinucléaires et la sérologie TORCH. Rarement utile, infection causant la mort est faite par l'histoire et l'examen du bébé, le placenta et le cordon.
- Le développement de technologies (22): hybridation génomique comparative, les tests pour les mutations d'un seul gène; tester pour mosaïcisme placentaire confiné et base d'acide nucléique test de l'infection.
Gestion de la grossesse actuelle avec la mort ftale
La plupart des femmes préfèrent procéder à l'expulsion du ftus après le diagnostic de mort ftale. Il est émotionnellement stressant de porter un foetus non viable, surtout en fin de gestation. Il est important d'offrir les deux options de livraison et de prise en charge expectative de femmes victimes de mort ftale. Les risques de prise en charge expectative comprennent l'infection intra-utérine et d'une coagulopathie maternelle. Ces risques sont mal caractérisées en raison de la rareté relative de la prise en charge expectative. Older rapports indiquent que 80-90% des femmes travaillent spontanément dans les deux semaines de mort ftale (3). Cependant, ce "temps de latence" délai peut être beaucoup plus longue. Il semble prudent d'effectuer une surveillance de l'infection et de la coagulopathie chez les femmes enceintes recevant des soins. Les exemples incluent l'évaluation de série de la température maternelle, des douleurs abdominales, des saignements et du travail. Visites régulières de bureau (par exemple hebdomadaire) peut être utile pour le soutien affectif et la surveillance médicale. Certaines autorités conseiller série (par exemple hebdomadaire) la détermination de l'hémogramme, numération plaquettaire, et le taux de fibrinogène. L'utilité de cette augmentation est incertaine. Une coagulopathie de consommation a été rapportée chez 25% des patients qui conservent un ftus mort pendant plus de 4 semaines (23), mais la condition est rare dans la pratique clinique et n'est généralement pas associée à des séquelles cliniques. Un taux de fibrinogène inférieur à 100mg/dL est considéré comme une preuve de coagulopathie. Les patients doivent être avisés de signaler immédiatement les symptômes tels que la fièvre, des douleurs, des saignements, des contractions, fuite de liquide ou pertes nauséabondes.
La méthode et le calendrier de livraison après la mort du ftus dépend de l'âge gestationnel au moment du décès, sur l'histoire de la mère d'une cicatrice utérine déjà présente, et la préférence maternelle. Bien que la plupart des patients veulent une livraison rapide, le délai de livraison n'est pas critique; coagulopathies sont associées à une rétention prolongée du ftus sont rares. Au deuxième trimestre, la dilatation et l'évacuation peuvent être offerts que si un fournisseur expérimenté est disponible, mais les patients doivent être informés que la dilatation et évacuation peut limiter l'efficacité de l'autopsie pour la détection des anomalies ftales macroscopiques. L'induction du travail est approprié à l'âge gestationnel plus tard. Avant 28 semaines de gestation, misoprostol par voie vaginale semble être la méthode la plus efficace de l'induction, indépendamment du cancer du col évêque score de (24), bien que la perfusion d'ocytocine à forte dose est aussi un choix acceptable. Dosages typiques pour l'utilisation du misoprostol par voie vaginale sont de 200 à 400 mcg toutes les 4-12 heures. Après 28 semaines de gestation, l'induction du travail devraient être gérés conformément aux protocoles habituels obstétricales. L'accouchement par césarienne pour mort ftale devrait être réservé à des circonstances inhabituelles parce qu'elle est associée à une morbidité maternelle potentiel sans aucun bénéfice du foetus. Plusieurs études ont évalué l'utilisation du misoprostol à la dose de 400 mcg toutes les 6 heures chez les femmes atteintes d'un enfant mort-né entre 24 et 28 semaines de gestation et une cicatrice utérine avant (25). Les données disponibles provenant d'essais randomisés prend en charge l'utilisation de misoprostol par voie vaginale comme un traitement médical pour mettre fin grossesses non viables avant 24 semaines de gestation (25). D'autres recherches sont nécessaires pour évaluer l'efficacité et la sécurité, voie d'administration optimale et la dose. Chez les patients après 28 semaines de gestation, la maturation du col avec un cathéter de Foley transcervicale a été associée à des taux de rupture utérine comparables à un travail spontané et cela peut être utile complément chez les patients atteints d'un examen défavorable col de l'utérus (26). Par conséquent, à partir de données limitées chez les patients avec une livraison avant césarienne transversale basse, épreuve du travail reste une option favorable. Il existe peu de données pour guider la pratique clinique chez un patient présentant une césarienne avant classique et le plan d'exécution doit être individualisée.
Le risque de mortinatalité après 32 semaines de gestation avec des augmentations de l'âge gestationnel et la moitié de ces morts foetales tardives se produisent à terme, en particulier chez les femmes âgées de plus de 35 ans (13). Enfant mort-né à terme peuvent théoriquement être évités grâce à l'utilisation judicieuse de l'induction du travail, et la prévention de mortinatalité est au cur de la plupart des indications reconnues pour l'induction du travail. Cependant, une fois que l'enfant est né, il ou elle fait face à de nouveaux risques de mortalité, souvent les risques qui peuvent être déterminées en partie par l'âge gestationnel à la naissance. Déterminer le moment optimal de l'accouchement pour minimiser le risque de mortinatalité doit nécessairement inclure l'examen du risque de mortalité rencontrés par l'enfant après la naissance. Pour les non-anomales nourrissons nés à terme, les causes les plus fréquentes de décès sont l'asphyxie, l'infection et la mort subite du nourrisson (SMSN). Les taux d'infection et la diminution des PEID avec l'augmentation de l'âge gestationnel à terme, avec les taux les plus élevés de 37 semaines (31). Le risque de décès à la fois néonatale et infantile a été démontré dans plusieurs études à diminuer avec l'âge gestationnel à terme, mais ensuite augmenter à nouveau après 41 semaines de gestation (31),(32). Une partie de la relation entre l'âge gestationnel et la mortalité infantile est motivée par le fait que le SMSN est la principale cause de mortalité post-néonatale mort non anormales nourrissons (33). Cette étude récente (34) estime que les multiples dimensions de risques encourus par les femmes enceintes et leurs fournisseurs de soins de santé lorsque l'on compare les risques de mortinatalité à terme avec le risque de mortalité infantile après la livraison. La conclusion était, taux de mortalité infantile à 39, 40 et 41 semaines de gestation sont plus faibles que le risque de mortalité globale de prise en charge expectative pendant 1 semaine. L'étude suggère que la livraison comporte un risque de mortalité plus grande que la gestion en expectative à 37 semaines de gestation, comporte un risque équivalent à 38 semaines de gestation, mais devient avantageux à 39 semaines de gestation et au-delà.
Deuil
La facilitation du deuil est une occasion importante pour les cliniciens pour aider les familles. Support du patient devrait inclure un soutien émotionnel et une communication claire des résultats des tests. Renvoi à un conseiller de deuil, un chef religieux, un groupe de soutien par les pairs ou professionnel de la santé mentale peut être utile pour la gestion de la douleur et de la dépression. Les sentiments de culpabilité ou de colère chez les parents qui ont vécu un décès périnatal sont fréquentes et peuvent être amplifiés quand il ya un enfant anormal ou d'un défaut génétique. Il est utile de mettre au point un protocole standard, en particulier dans les unités qui fournissent rarement des morts ftales (27). Les patients devraient se voir offrir la possibilité de tenir leurs enfants et de garder des souvenirs tels que des images, des pieds et empreintes de mains, et des moulages en plâtre. Certains parents peuvent accueillir discussion et trouver un soulagement dans les résultats de l'autopsie. Les résultats des tests sont importants, même en l'absence de diagnostic spécifique est identifié. Les patients devraient être autorisés à faire des choix autant que possible au sujet de leur expérience. Hospitalisations prolongées ne sont pas nécessaires et la récupération post-partum dans les salles doivent être évités.
Gestion grossesse ultérieure
Le risque pour pratiquement toutes les issues défavorables de grossesse sont influencés par les antécédents obstétricaux et de mortinaissance avant ne fait pas exception. Le risque de récurrence de mortinatalité n'est pas bien étudiée et des chiffres fiables pour les patients individuels sont souvent indisponibles. Une récente étude de population du Missouri noter taux de mortinatalité de 22,7 pour 1000 chez les femmes avec enfant mort-né avant, ce qui représente un odd ratio de 4,7 par rapport aux femmes sans enfant mort-né avant (28). L'augmentation des risques de récurrence ont été notées dans les Afro-Américains (35,9 / 1,000) par rapport aux Blancs (28). Le counseling peut être entravée par l'insuffisance des informations concernant l'étiologie de la mortinatalité préalable. Dans de nombreux cas, la mortinaissance, avant peut-être inexpliqué malgré une évaluation approfondie. Voici les éléments clés de la gestion:
- Avant la grossesse ou l'initiale visite prénatale: détail les antécédents médicaux et obstétricaux, d'évaluation et de bilan de mortinatalité précédente, la détermination du risque de récidive; arrêt du tabac, perte de poids chez les femmes obèses en période préconceptionnelle, conseil génétique si l'état de la famille génétique existe, écran diabète, thrombophilie bilan - anticorps antiphospholipides que s'il est explicitement indiqué, le soutien et le réconfort.
- Premier trimestre: dating échographie; premier trimestre écran - associée à la grossesse plasmatique de la protéine A, la gonadotrophine chorionique humaine, et de la clarté nucale (29), le soutien et le réconfort.
- Deuxième trimestre: du ftus par échographie anatomique enquête à 18-20 semaines de gestation; dépistage sérique maternel (Quadruple) ou simple alpha foetoprotéine marqueur si dépistage du premier trimestre (29), le soutien et le réconfort.
- Troisième trimestre: le dépistage échographique de la croissance ftale après 28 semaines de gestation; compte coup de pied à partir de 28 semaines de gestation. De nombreuses études ont démontré que les femmes qui signalent une diminution des mouvements du ftus sont plus à risque d'issue périnatale indésirable (30). Bien que le comptage coup ftale est un test peu coûteux de bien être ftal, l'efficacité dans la prévention de mortinatalité est incertaine. Antepartum surveillance ftale à partir de 32 semaines de semaines de gestation ou 1-2 plus tôt que mortinatalité préalable. Il est à noter qu'en plus de la perte de grossesse récurrente, de mortinaissance avant augmente le risque de complications obstétricales, y compris de nombreux restriction de la croissance intra-utérine, décollement placentaire, et de naissance prématurée. Procédé de surveillance le plus couramment utilisé est le test non-stress. Vélocimétrie Doppler, les index de liquide amniotique, et ultrasonogrammes série d'évaluer la fonction placentaire. Malgré les assurances, le patient est susceptible d'être anxieux et à exiger un soutien continu. En effet, une grande part de fournir de bons soins pour les grossesses ultérieures chez les femmes avec enfant mort-né avant est de tendre à des besoins émotionnels des patients. Les visites fréquentes, la documentation des bruits du cur du ftus et le bien-être et beaucoup de renforcement positif sont inestimables.
- Moment de la livraison: la décision de procéder à la livraison précoce pour prévenir les mortinaissance doit intégrer une compréhension des risques accrus de complications maternelles et néonatales par rapport aux avantages potentiels. Les livraisons avant 39 semaines de gestation sont associées à un risque accru d'admission à l'unité néonatale de soins spéciaux pour des complications respiratoires et d'autres morbidités néonatales. La plupart des auteurs suggèrent induction élective à 39 semaines de gestation, si l'accouchement avant 39 semaines de gestation est décidé que la maturité pulmonaire foetale documentée par amniocentèse est conseillée.
Résumé
Malgré l'amélioration des soins prénatals et intrapartum, de mortinatalité, défini comme mort ftale in utero à 20 semaines de gestation ou plus, des vestiges et important, problème largement ignoré, et poignant en obstétrique. Plus de 26.000 enfants mort-nés ont été signalés aux États-Unis en 2004. Bien que plusieurs conditions ont été liés à la mortinaissance, il est difficile de définir l'étiologie précise dans de nombreux cas. Cette revue discute des causes connues et soupçonnées de mortinatalité, y compris des anomalies génétiques, des infections, hémorragie fto-maternelle, et une variété de conditions médicales chez la mère. La proportion des mort-nés qui ont une explication de diagnostic est plus élevé dans les centres qui effectuent une évaluation définie et systémique. En femmes à faible risque avec une mortinaissance inexpliquée le risque de mortinatalité récidive après 20 semaines de gestation est estimée à 7.8 au 10.5 pour 1000 naissances avec la plupart de ce risque survenant avant 37 semaines de gestation. Le facteur de risque le plus répandu associé à la mortinaissance est non-hispaniques race noire, la nulliparité, l'âge maternel avancé, et l'obésité. Le risque de mortinatalité ultérieure est deux fois plus élevé pour les femmes avec une croissance du nourrisson, avant nés vivants restreint délivré avant 32 semaines de gestation que chez les femmes ayant un enfant mort-né avant. L'amniocentèse pour caryotype ftal a le rendement le plus élevé et est particulièrement utile si la livraison ne devrait pas immédiatement.
Au deuxième trimestre, la dilatation et l'évacuation peuvent être offerts. L'induction du travail est également approprié à des âges gestationnels plus tard, si la dilatation du deuxième trimestre et l'évacuation n'est pas disponible, ou en fonction des préférences du patient. Déclenchement du travail misoprostol par voie vaginale est sûr et efficace chez les patients atteints d'une césarienne antérieure avec une cicatrice utérine transversale basse avant 28 semaines de gestation. Le optimale "bilan" de mortinatalité est incertaine. Le test le plus important dans l'évaluation d'un enfant mort-né est autopsie ftale; examen du placenta, le cordon et les membranes et l'évaluation caryotype. D'autres tests à considérer Kliehauer-Betke, dépistage d'anticorps, la sérologie de la syphilis, anticorps anticardiolipine, anticoagulant lupique écran, le test de thrombophilies héréditaires, écran toxicologique des urines et une sérologie parvovirus. Grossesses ultérieures peuvent être à risque accru de complications de mortinatalité et d'obstétrique. Traitement des soins médicaux sous-jacents ou des conditions obstétricales, la surveillance prénatale, et l'induction du travail avec la maturité ftale peut améliorer les résultats. Support du patient devrait inclure un soutien émotionnel et une communication claire des résultats des tests. Renvoi à un conseiller de deuil, un chef religieux, un groupe de soutien par les pairs ou professionnel de la santé mentale peut être utile pour la gestion de la douleur et de la dépression.
Remerciements: nous remercions le Dr Robert M. Silver, professeur d'obstétrique et de gynécologie, Chef de la Division de la médecine maternelle et foetale, University of Utah Health Sciences Center, Salt Lake City, Utah (États-Unis) pour les contributions et suggestions utiles à la préparation du manuscrit. Un merci spécial au Conseil d'administration pour assurer le financement de la recherche et du développement.
Suggestions de lecture
- Mortinatalité Collaborative Research Network (SCRN)
de recherche afin de déterminer l'étendue et les causes de mortinaissance
https://scrn.rti.org/ - Mondiale de la Santé (OMS)
Mortinaissances
http://www.who.int/reproductivehealth/topics/maternal_perinatal/stillbirth/en/
Références
- Stanton C, Lawn JE, Rahman H, et al. Stillbirth rates: delivering estimates in 190 countries. Lancet 2006;367:1487-1494
- MacDorman MF, Hoyert DL, Martin JA, et al. Fetal and perinatal mortality, United States, 2003. Natl Vital Stat Rep 2007;55:1-17
- Silver RM. Fetal death. Obstet Gynecol 2007;109:153-167
- National Center for Health Statistics. State definitions and reporting requirements for live births, fetal deaths, and induced terminations of pregnancy. 1997 revision. Hyattsville (MD): NCHS; 1997. Available at: http://www.cdc.gov/nchs/data/misc/itop97.pdf Accessed 12 June 2012
- Silver RM, Varner MW, Reddy UM, et al. Work-up of stillbirth: a review of evidence. Am J Obstet Gynecol 2007:196(5):433-444
- Gardosi J, Kady SM, McGeown P, et al. Classification of stillbirth by relevant condition at death (ReCoDe): population based cohort study. BMJ 2005;331:1113-1117
- Fretts RC. Etiology and prevention of stillbirth. Am J Obstet Gynecol 2005;193:1923-1925
- McClure EM, Nalubamba-Phiri M, Goldenberg RL. Stillbirth in developing countries. Int J Gynecol Obstet 2006;94(2):82-90
- Korteweg FJ, Bouman K, Erwich JJ, et al. Cytogenetic analysis after evaluation of 750 fetal deaths: proposal for diagnostic workup. Obstet Gynecol 2008;111:965-874. (Level III)
- Laury A, Sanchez-Lara PA, Peokowitz S, et al. A study of 534 fetal pathology cases from prenatal diagnosis referrals analyzed from 1989 through 2000. Am J Med Gent A 2007;143A:3107-3120. (Level III)
- American College of Obstetricians and Gynecologists (ACOG) Practice Bulletin. Management of stillbirth. Number 102; March 2009. Obstet Gynecol 2009;113:748-761
- Reddy UM, Goldenberg R, Silver RM, et al. Stillbirth classification developing an international consensus for research. Obstet Gynecol 2009;114:901-914
- Reddy UM, Ko CW, Willinger M. Maternal age and the risk of stillbirth throughout pregnancy in the United States. Am J Obstet Gynecol 2006;195:764-770. (Level II-3)
- Huang DY, Usher RH, Kramer MS, et al. Determinants of unexplained antepartum fetal deaths. Obstet Gynecol 2000;95:215-221. (Level II-3)
- Goldenberg RL, Thompson C. The infectious origins of stillbirth. Am J Obstet Gynecol 2003;189(3):861-873
- Hassan J, Connell J. Translational mini-review series on infectious disease: congenital cytomegalovirus infection: 50 years on. Clin Exp Immunol 2007;49(2):205-210
- Skjoldebrand-Sparee L, Tolfvenstam T, Papdogiannakis N, et al. Parvovirus B19 infection: association with third-trimester intrauterine fetal death. BJOG 2001;107(4):476-480
- Centers for Disease Control and Prevention (CDC). Congenital syphilis United States, 2002. MMWR Morb Mortal Wkly Rep 2004;53(31):716-719
- Montoya JG, Remington JS. Management of Toxoplasma gondii infection during pregnancy. Clin Infect Dis 2008;47(4):554-566
- Fretts RC. Etiology and prevention of stillbirth. Am J Obstet Gynecol 2005;193:1923-1935. (Level III)
- Wapner RJ, Lewis D. Genetics and metabolic causes of stillbirth. Semin Perinatol 2002;26:70-74
- Christiaens GC, Vissers J, Poddighe PJ, et al. Comparative genomic hybridization for cytogenetic evaluation of stillbirth. Obstet Gynecol 2000;96:281-286
- Korteweg FJ, Erwich HM, Timmer A, et al. Evaluation of 1025 fetal deaths: proposed diagnostic workup. Am J Obstet Gynecol 2012;206:53.e1-12
- Tang OS, Lau WH, Chan CC, Ho PC. A prospective randomized comparison of sublingual and vaginal misoprostol in second trimester termination of pregnancy. BJOG 2004;111:1001-1005. (Level I)
- Dickinson JE. Misoprostol for second-trimester pregnancy termination in women with a prior cesarean delivery. Obstet Gynecol 2005;105:352-356. (Level II-2)
- Bujold E, Blackwell SC, Gauthier RJ. Cervical ripening with transcervical Foley catheter and the risk of uterine rupture. Obstet Gynecol 2004;103:18-23. (Level II-2)
- Leduc L, Farine D, Armson BA, et al. Stillbirth and bereavement: guidelines for stillbirth investigation. Maternal-Fetal Medicine Committee; Clinical Practice Obstetrics Committee. J Obstet Gynecol Can 2006;28:540-552. (Level III)
- Sharma PP, Salihu HM, Oyelesse Y, et al. Is race a determinant of stillbirth recurrence? Obstet Gynecol 2006;107:391-397
- Reddy UM. Prediction and prevention of recurrent stillbirth. Obstet Gynecol 2007;110:1151-1164
- Froen JF. A kick from within fetal movement counting and the cancelled progress in antenatal care. J Perinat Med 2004;32:13-24
- Zhang X, Kraner MS. Variations in mortality and morbidity by gestational age among infants born at term. J Pediatr 2009;154:358-362, 362.e1
- Donovan EF, Besl J, Paulson J, et al. Ohio Perinatal Quality Collaborative. Infant death among Ohio resident infants born at 32 to 41 weeks of gestation, Am J Obstet Gynecol 2010;203:58.e1-5
- Halloran DR, Alexander GR. Preterm delivery and age of SIDS death. Ann Epidemiol 2006;16:600-606
- Rosenstein MG, Cheng YW, Snowden JM, et al. Risk of stillbirth and infant death stratified by gestational age. Obstet Gynecol 2012;120:76-82
Publié: 23 November 2012
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


