遗传性风险评估妇科
WHEC实践公报和临床管理指南为医疗保健提供者。 教育捐赠的妇女提供健康和教育中心(WHEC)。
遗传性癌症的风险评估应该是例行的妇产科实践的一部分。在过去的十年中一直存在广泛的疾病,包括癌症,心脏疾病,糖尿病的遗传倾向日益认识。这些都是复杂的多基因疾病,但允许这些条件的倾向相关的特定基因的鉴定,临床医生更准确地评估风险,并规定预防性干预措施。虽然它可能是不熟悉的很多从业者,癌症的危险分层的过程中能高效,有效。使用协议驱动评价癌症的易感性,个人和家庭的风险因素,和基因检测,它是能够创建演示证明减少癌症的发病率和死亡率的风险状况和管理策略。前几十年,基因检测进入实践中,乳腺癌和卵巢癌的临床医生有一个不必要的负担,往往早期发病患者与男性乳腺癌。在20世纪90年代中期,连锁分析,在这些乳腺癌和卵巢癌的家庭使BRCA1和BRCA2基因的鉴定,基因,通常在DNA修复功能。癌症遗传辅导员利用系谱分析和临床指标来评估病人进行遗传突变的概率,其中日益复杂的阵列市售检测,以确定适当的测试策略,并解释结果和引导医疗建议。的科学发现,广泛的公众意识和BRCA1和BRCA2基因负责大部分家族性乳腺癌和卵巢癌的临床基因检测的一般可用性,已导致女性到目前医生办公室基因检测的要求和质疑的临床意义,他们和他们的家人。
本文件的目的,检讨目前的建议,易患癌症,包括卵巢,输卵管,乳腺癌,子宫内膜癌,结肠癌,由于继承了BRCA基因突变或错配修复基因与遗传性非息肉性结肠癌相关的基因检测(HNPCC)综合征。家庭历史遗存的基石患者识别。种族和种族定期评估作为评估的一部分。肿瘤易感性基因检测的实际应用能力,以减少遗传性癌症的负担,挽救生命,减少医疗并发症,减少心理压力。基因突变携带者,包括降低风险的手术,癌症筛查,随访的适应症,管理也都应有尽有。审查报告还侧重于临床实践和临床癌症遗传学的实际使用。
背景
有许多综合征赋予继承造成这些常染色体显性遗传性癌症综合征(1) ,(2)所有乳腺癌和卵巢癌的5%至15%的乳腺癌,卵巢癌及相关癌症的风险。在孟德尔常染色体显性遗传的方式传输的所有相关的基因与遗传性癌症综合征,所以母亲和父亲的家族病史同样有助于患者的风险,需要进行评估,以确定合适的测试。,但是,应当指出的是,虽然以常染色体显性方式遗传的基因突变,他们在隐性方式(2)表示。谁继承了一般一个拷贝的基因失活的胚系突变的个体有第二个功能完整的基因副本。它是只有当该剩余的正常的拷贝变得突变,细胞可能会经历恶性转化的过程。
产科医生和妇科医生的角色包括:
- 认识家族性疾病模式暗示癌症遗传易感性,包括熟悉和常见的遗传性乳腺癌和卵巢癌综合征(HBOC)和遗传性非息肉病性大肠癌(HNPCC或Lynch综合征);
- 结合风险评估,遗传测试,并解释到日常实践的结果;
- 根据危险分层指导医疗管理。
危险分层:零星的风险,家族风险及遗传风险
超过10%的患者有个人或家族健康史,提示遗传性或家族性的癌症易感性,超过6%的患者达到国家综合癌症网络(NCCN)进行基因测试的标准。 (3). 已经出现三种风险:
- 零星的风险,定义为平均人口或低风险的患者;
- 家族性风险,定义为一家拥有众多与特定类型或恶性肿瘤的亲属;
- 遗传风险,定义为一个单一的癌症的存在下或在一个家庭中,这是与已知的遗传性有害突变在特定的基因(即,BRCA)的恶性肿瘤的一种综合征。
遗传风险进行癌症易感性的比例最高,而零星的风险进行最低。风险分层,我们可以找出谁可能会受益于密集的筛选,基因检测,化学预防和减少手术风险的干预措施,如个人。适当的个人基因检测进一步使我们能够识别与遗传性癌症综合征的患者,为了自己的利益,以及他们的整个家庭。一旦癌症家族病史是确定的,下面讨论的模型被用来预测一个特定癌症的病人的基因突变的遗传性癌症综合征的可能性。知情同意,包括风险,福利,期权和期望,应该充分讨论。在一个不正常的家庭或个人的癌症病史的情况下,直接意见是必要的。非直接辅导,减少病人的增加监视和潜在的早期诊断和预防癌症的机会,使医生在未来的责任的风险。
遗传性乳腺癌和卵巢癌(HBOC)综合征
遗传性乳腺癌和卵巢癌(HBOC)综合征是一种遗传性的癌症易感性综合征。这种综合征的多个家庭成员与乳腺癌或卵巢 癌或两个,两个乳房癌和卵巢癌的存在下在一个单一的个人和早期乳腺癌的发病年龄的标志。在20世纪90年代中期,它表明,BRCA1和BRCA2基因的遗传突变,分别为17和13号染色体上,负责为家族性乳腺癌和卵巢癌。女性和男性都可能带有BRCA突变基因,并把它传递给自己的后代。
"红旗"为HBOC综合征-个人和三代的家族病史,包括 (4):
- 乳腺癌:绝经前或未满50年来,双边,三阴性,或男性;
- 卵巢癌:任何年龄,浆液性上皮通常,高品位;
- 胰腺癌,黑色素瘤,前列腺癌:50岁以下;
- 民族倾向:德系犹太人和其他人(例如,墨西哥,冰岛人,荷兰,匈牙利);
- 在家庭中的一个已知的BRCA基因突变。
BRCA1 和 BRCA2
卵巢癌和3-5%的乳腺癌病例约10%的病例是由于胚系突变的BRCA1和BRCA2 (1) ,(5), 17号染色体上发现BRCA1和BRCA2是13号染色体上。已超过1,200种不同的突变BRCA1,BRCA2已报告超过1300种不同的突变BRCA1和BRCA2基因是抑癌基因的编码蛋 白质的DNA修复过程中的功能(6) 。虽然个人HBOC综合征继承他们的父亲或母亲在BRCA1和BRCAA2基因的一个有缺陷的等位基因,他们有第二次,功能性等位基因。如果第二变得非功能性等位基因,癌症可以通过额外的突变的积累发展。这就是所谓的"二次打击假说" (7) 。在一般人群中,据估计,约1 300至1 800个人携带BRCA1和BRCA2基因 中的突变(8) 。德系犹太人人口代表一个显着的例外,因为具体有三个创始人突变BRCA1基因密码子185deletion AG,BRCA1基因密码子5374插件C,和BRCA2 6174位密码子缺失Ť进行约2.5%的个人(8) 。鉴于此,大多数专家都犹太女性基因检测阈值低得多。
与BRCA1突变,对于一个女人来说,卵巢癌的风险是39-46%。与BRCA2基因突变对于一个女人来说,卵巢癌的风险是12-20%。估计一生中患乳腺癌与BRCA1或BRCA2基因突变是65-70%(9) 。对于女性患乳腺癌,10年精算开发后续卵巢癌的风险是BRCA1基因突变携带者为12.7%和6.8%,BRCA2基因突变携带者(10) 。卵巢癌与BRCA1和BRCA2基因突变相关,具有明显的组织学表型。这种类型的癌症主要是浆液性或子宫内膜组织学和高品位。粘液性交界性卵巢癌不会出现瘤谱(11)的一部分。原发性输卵管癌和原发性腹膜癌也与BRCA1和BRCA2基因突变(12)相关的疾病谱。
遗传风险评估标准
患者具有更大的比约20-25%的几率有遗传倾向的乳腺癌和卵巢癌的遗传风险评估的建议 (13):
- 女性乳腺癌和卵巢癌的*的个人历史
- 妇女卵巢癌*和近亲†与卵巢癌或绝经前乳腺癌或两者兼而有之;
- 妇女与卵巢癌*谁是犹太人祖先;
- 患有乳腺癌的妇女年龄在50岁或以下的近亲†在任何年龄的男性乳腺癌与卵巢癌*;
- 是犹太人的祖先在人乳腺癌的妇女被确诊年龄为40岁或以下;
- 妇女与近亲†与已知的BRCA1或BRCA2基因突变。
*腹膜和输卵管癌,应考虑HBOC综合征的频谱的一部分。
†近亲被定义为一个一级亲属(母亲,姐妹,女儿)或二级亲属(奶奶,孙女,阿姨,侄女)。
患者与大于大约5-10%的几率有遗传倾向的乳腺癌和卵巢癌的遗传风险评估可能是有帮助的 (13):
- 乳腺癌的妇女年龄在40岁或以下;
- 妇女卵巢癌,原发性腹膜癌或输卵管癌的高品位,在任何年龄的浆液性组织学;
- 双侧乳腺癌的妇女(特别是如果第一例被确诊乳腺癌的年龄在50岁或以下);
- 患有乳腺癌的妇女年龄在50岁或以下,并与乳腺癌年龄在50岁或以下的近亲;
- 德系犹太人的祖先与乳腺癌在50岁或年轻妇女;
- 妇女乳腺癌与乳腺癌在任何年龄,任何年龄进行两个或两个以上的近亲(特别是如果至少有一例被确诊乳腺癌的年龄在50岁或以下);
- 不受妇女与近亲符合以前的标准之一。
HBOC综合征风险评分工具
我们已经开发了一个简单的数值教学工具,可以用来估计病人的BRCA测试候选人。此工具接近NCCN指南分配1点或2点到每个人,每个"红旗"有关癌症的三代家庭树。病人的点被加在一起与母体点,然后再次与父本点。一笔0点,将表明的零星(低)分类。一笔1点通常会表明家族(中)风险分类;然而,1点的病人仍可能有资格获得基因检测,如果有一个有限的家庭结构或BRCA突变的种族易感性。> 2分的一笔一般会BRCA测试资格,但涉及第三亲属可能的组合进行评估,以确定是否是必要的测试。这个工具应该只作为一个估计值,而不是一个决定性的测试指南。
圈适用,那么总+ B和a + c的每个癌症
- 任何1点=家族性风险,可能的遗传风险,如果小的家庭(LFS)
- 任何1点=家族性风险,可能的遗传风险,如果小的家庭(LFS)
每一个原发癌的单独统计
家庭= 1 届和第2 届的亲属(有时3 次程度)
母亲和父亲的分数分别增加病人
| Patient (a) | Maternal (b) | Paternal (c) | |
| Breast, <50 years (premenopause) | 2 | 1 | 1 |
| Breast, <60 years, triple negative | 2 | 1 | 1 |
| Breast, >50 years, not triple negative | 1 | 1 | 1 |
| Breast, bilateral, any age | 2 | 2 | 2 |
| Breast, male, any age | 2 | 2 | 2 |
| Ovary, epithelial, any age | 2 | 2 | 2 |
| Pancreas | 1 | 1 | 1 |
| Known mutation carrier | - | 2 | 2 |
| Ashkenazi Jewish (or other high-risk group) |
1 | 0 | 0 |
| Total: a+b = ---------- points; a+c = ---------- points | |||
HBOC, hereditary breast and ovarian cancer; LFS, Li-Fraumeni syndrome
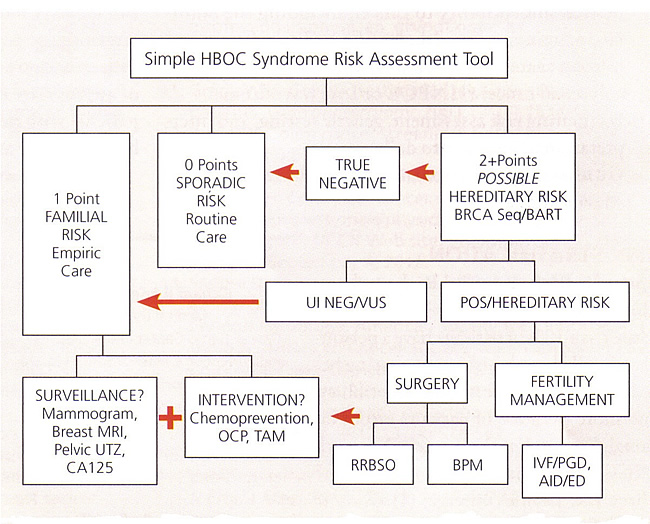
Abbreviations: AID, artificial insemination by donor; BART, BRCA Analysis rearrangement test; BPM, bilateral prophylactic mastectomy; CA 125, cancer antigen 125; ED, egg donation; HBOC, hereditary breast and ovarian cancer; IVF, in-vitro fertilization; MRI, magnetic resonance imaging; OCP, oral contraceptive pills; PGD, preimplantation genetic diagnosis; POS, positive; RRBSO, risk-reducing bilateral salpingo-oophorectomy; TAM, tamoxifen; UI NEG, uninformative negative; UTZ, ultrasound; VUS, variant of uncertain significance.
遗传咨询,以减少患乳腺癌的风险
遗传咨询应包括讨论可能的结果的测试 - 具体解决问题的积极的,消极的,既不营养测试结果,或意义不明的变种。监测,化学预防,降低风险的手术,在测试前,应讨论的选项。还应当考虑可能的心理和家族性的测试结果的影响。书面材料可以帮助个人信息共享与亲人关于其潜在的遗传风险。还应包括遗传咨询会议讨论了基因检测的成本。许多保险公司,包括医疗保险,将覆盖牺牲某些个人的一个重要部分。医疗保险和其他保险公司的书面指引,覆盖基因检测的成本。遗传咨询的一个重要方面是讨论现行立法关于基因歧视和遗传信息的隐私。2008年联邦遗传信息无歧视法案保护个人对健康和就业歧视的基础上的遗传信息。许多国家也有提供类似保护的国家法律。这些法律并不适用于其他形式的保险,其中可能包括生命或伤残保险。
理想的情况下,它是有道理的,在受影响的个人开始测试。然而,如果没有受影响的个体,基因检测仍然可以提供有用的信息。如果有害突变的识别,高危患者可以适当的劝告有关筛查或其他减少风险的方法。如果没有有害突变是确定的,患者需要接受辅导,这可能是因为几种可能性,其中包括(一)有害突变存在于病人的家人,没有继承;(二)在BRCA1和BRCA2基因突变检测不到,或身份不明的癌症易感基因是目前在家庭中,它仍是未知病人是否共享这个倾向;或(c)没有在家庭遗传倾向。
目前的策略,以减少已知的有害BRCA基因突变的高风险的妇女患卵巢癌或输卵管癌的风险,包括监测,化学预防,手术。共识组给予了极高的BRCA1和BRCA2基因突变的妇女卵巢癌和输卵管癌的风险,建议定期检查与CA 125和阴道超声检查,年龄为30年,35年或5-10年之间开始较早比第一诊断卵巢癌的最早年龄在家庭(14) 。卵巢癌的发病率较低和筛选检测呈阳性结果需要进一步微创手术评估的可能性很高,是在继承的风险(15)妇女在卵巢癌筛查方案的障碍。希望未来卵巢癌的试验将受益于更好的血清标志物和改进筛选算法,以提高能力,以区分正常和异常的CA-125值和超声结果。BRCA突变的妇女口服避孕药的风险降低的好处和幅度尚未见报道,一般情况下,低危人群一致。BRCA1和BRCA2基因突变的妇女,这是合理使用口服避孕药。大多数研究报告在那些使用口服避孕药的持续时间较长(超过3至6岁)(16)卵巢癌的风险降低。为化学预防和生殖控制的风险和收益相对应仔细权衡病人和她的医生。
预防性双侧输卵管卵巢切除术(BSO)
强烈推荐妇女谁携带BRCA基因突变,因为卵巢癌的死亡率高和缺乏有效的筛查和预防方法(17) 。幸运的是,遗传性乳腺癌和卵巢癌的风险并没有大幅上升,直到与BRCA1基因突变,BRCA2基因突变的妇女(18)和50年代末30年代后期的妇女,所以妇女有机会接受BSO之前完成他们的家庭。以往的做法进行预防性手术,仅根据家族史,在很大程度上应该被抛弃。BRCA突变的女性在家庭中的一半将是运营商不能指望。目前主要基于BRCA基因突变分析的结果,决定进行预防性BSO手术。有一些证据表明,某些类型的BRCA基因突变可能诱发更强烈的卵巢癌,但这个观察始终没有被证实(19) 。BSO虽然是一个重大的外科手术,有研究表明,大多数高风险的妇女接受基因检测接受预防性双侧输卵管卵巢切除术。腹腔镜和开腹手术都是为降低风险BSO的选项。对于这两个程序,腹膜表面彻底的检查是必要的。腹腔冲洗应获得。膈肌,肝脏,大网膜,肠管,结肠旁沟,阑尾在腹部检查。卵巢,输卵管,子宫,膀胱浆膜及尽头囊骨盆检查。任何不正常的地方应进行活检。应分离卵巢血管结扎近侧的端部的可识别的卵巢组织,以确保所有的卵巢组织被完全除去。如果不是正在执行一个子宫切除术,输卵管应被划分在其插入到子宫大角。进行腹腔镜手术时,为了优化保存在卵巢表面上皮,试样可以放置在内窥镜袋去除前腹部。决定进行并发子宫切除术应个体化。有利于子宫切除术的参数包括一个更加简化的激素治疗策略(只与雌激素)和角膜输卵管(20)的理论增加患癌症的风险。此外,可考虑子宫切除时切除子宫和宫颈有其他医疗指征。对于服用他莫昔芬的女性,可考虑子宫切除,以减少子宫内膜癌的风险 (21).
风险的优点和缺点,减少输卵管卵巢切除术的y
优点:
- 降低卵巢癌和输卵管癌的发病率和死亡率;
- 经常可以延迟,让育龄完成;
- 腹腔镜的方法可能在大多数情况下;
- 影响身体形象普遍接受;
- 雌激素替代疗法可以防止手术绝经的后果;
- 降低患乳腺癌的风险。
缺点:
- 成本;
- 潜在的发病率和死亡率;
- 随后原发性腹膜癌小,但剩余的潜力;
- 手术更年期的绝经前患者选择不采取激素替代。
考虑降低风险的输卵管卵巢切除术什么年龄?
降低风险和选修输卵管卵巢切除切除卵巢和输卵管防止长期的发病率和死亡率的潜在利益。长期降低风险的输卵管卵巢切除术意味着被清除时,卵巢是正常的。BRCA1或BRCA2基因突变的妇女应提供降低风险的输卵管卵巢切除术的40岁,或生育时是完整的(13) 。小于2-3%的BRCA1或BRCA2基因突变在40岁之前妇女将被诊断卵巢癌。对于妇女与BRCA1基因突变,卵巢癌的风险显着增加在40年代期间,有10-21%的BRCA1基因突变携带者患卵巢癌的50岁。绝经前卵巢癌的风险低得多BRCA2基因突变携带者,BRCA2基因突变携带者患卵巢癌的年龄在50岁(13) ,(22)不超过3% 。由于卵巢癌的风险不同的时机,可以考虑辅导BRCA1基因突变的患者不同于BRCA2基因突变携带者。然而,与BRCA2基因突变的妇女有26-34%的机会患乳腺癌的年龄50岁(18) ,(22) ,早期的卵巢被切除,达到去除卵巢患乳腺癌的风险减少的最大效益(23) 。鉴于这些问题,降低风险的输卵管卵巢切除术,应根据个别病人的需要,并考虑到他们渴望保留生育功能或防止过 早手术绝经年龄依赖性的影响,降低风险的输卵管卵巢切除术在两个乳房的时机癌症和妇科癌症的风险。
预防性输卵管切除术和卵巢切除术延迟
建议预防性双侧输卵管卵巢切除术的BRCA基因突变的妇女,但也有不利后果过早绝经。多数出现BRCA相关卵巢癌发生在输卵管,因此,输卵管双侧输卵管卵巢切除术可能是一种替代。的理解,也许60%的盆腔浆液性癌可能起源于输卵管,出现了更近的讨论,降低风险的的输卵管作为一个潜在的替代风险减少BSO用于治疗BRCA突变基因携带者,尤其是妇女不愿意进行风险减少BSO (39) 。发表他们的马尔科夫蒙特卡洛模拟比较减少风险的降低风险延迟双侧卵巢切除输卵管在40岁,50岁(40)在40岁的BSO 。这种周到的模型预测盆腔浆液性癌,乳腺癌和增量因心血管疾病死亡的人数预期减少。研究结论是双侧输卵管卵巢切除术往往是最大的BRCA突变基因携带者之间的乳腺癌和卵巢癌的风险降低。然而,当考虑质量调整寿命延迟卵巢切除术,双侧输卵管是一个符合成本效益的策略,对于那些不愿意接受双侧输卵管卵巢切除术(40)可能是一个可以接受的替代品。重要的是,强调照顾继承BRCA1和BRCA2基因胚系突变的妇女,该标准仍然预防性BSO完成生育后或年龄在40岁左右。它提供了最大的降低风险的输卵管有或无延迟卵巢切除术相比,乳腺癌和卵巢癌。然而,一个显着的女性比例不接受BSO,很多人会选择单独用于卵巢癌的监控现有的筛查方法(41),尽管在有限的利益。卵巢癌驱动BRCA突变携带者的死亡率,因此任何干预,可降低卵巢癌的风险是可能被前瞻性验证延迟卵巢切除术,双侧输卵管可能是一个合理的替代BSO,特别是对那些谁也不愿意接受后者因为对生活质量的潜在影响的过程。
谁拥有一个强大的家族历史和负的BRCA1或BRCA2基因突变的妇女管理
虽然,在大多数情况下,对卵巢癌的遗传倾向在BRCA1或BRCA2基因突变引起的,目前的技 术不允许,必须存在于这些基因(24)的所有突变的鉴定。此外,连锁研究表明,不到一半的家庭有四个或更多的乳腺癌病例,但无一例卵巢癌(与特定站点乳腺癌的家庭),乳腺癌是由BRCA1或BRCA2基因突变(25 )。鉴于这些问题,个人或家庭的BRCA突变检测结果呈阴性乳腺癌病史的妇女应管理的基础上,他们的家族病史。初步数据表明,妇女从家庭与特定地点没有BRCA突变的乳腺癌被确定的历史仍然在显着增加患乳腺癌的风险,但可能不会在卵巢癌的风险显着增加(26) 。重要的是,高风险的个人经历的妇女保健的风险增加,迅速 发展的研究和改进测试技术与临床医生保持联系。例如,一个大的重组在BRCA1和BRCA2基因测试已经开发出来,可能有助于确定先前测试这些基因阴性的高风险家庭中的一小部分突变。
生殖选项
基因检测结果,对计划生育决策可以产生深远的影响,对个人的生育年龄被发现的BRCA1 / 2突变携带者。例如,在双方的合作伙伴的情况下,携带BRCA2基因突变,有可能是一个高风险的后代,制定了罕见的范可尼贫血/脑肿瘤的表型(隐性遗传疾病)。咨询生殖选项,如产前诊断,胚胎植入前遗传学诊断(PGD)和辅助生殖技术可能因此被保证夫妇表示关注他们的后代在BRCA突变携带者状态。这种辅导应包括生殖选项的潜在风险,好处和限制,全面讨论。产前诊断涉及植入后的遗传分析早期胚胎,利用绒毛膜绒毛或羊水流体细胞样本,进行基因检测通常是一周12和第16周的妊娠之间,测试结果可能会潜在地导致一对夫妇决定终止妊娠 (27).
在过去的二十年中,PGD已成为早期胚胎的基因检测作为一种替代方法。PGD 涉及在非常早期的发展阶段,从胚胎中的1或2个细胞(即,6至8个细胞)的测试后,在体外受精(IVF)。此步骤用于选择未受影响的胚胎转移到子宫,可能,因此,提供的优点是避免了潜在的终止妊娠。然而,如PGD程序也不是没有限制的,因为它可能仍然需要验证产前诊断,取决于一对夫妇的医疗需求或请求。此外,PGD过程中需要使用试管婴儿不管夫妇的生育状态(即,也适用于没有不孕问题的夫妇),并IVF可能并不总是导致成功怀孕。最后,技术或专业知识可能不是现成的一对夫妇的地理位置。各种因素的影响,医疗和个人,必须权衡决定利用产前诊断,或PGD。医疗可能包括考虑因素,如年龄发病的遗传性癌症,外显率,严重程度或相关的癌症发病率和死亡率,有效降低患癌症的风险的方法或有效的治疗方法的可用性。虽然使用相对完善的产前诊断,或PGD严重的遗传性疾病,具有非常高的渗透率较低的渗透率(如遗传性乳腺癌或卵巢 癌综合征)相关的条件,它们的使用仍然有些争议,从一个道德和监管的角度来看。个人因素决定利用产前诊断,或PGD可能包括个人的道德信仰,价值体系,文化和宗教的信仰,以及社会和经济因素。根据管理遗传性乳腺癌或卵巢 癌的高风险妇女的调查结果,50%-75%的受访者认为,PGD是一个可接受的选择高风险的个人,但只有约14%-33%会考虑接受PGD自己(28) 。重要的是,调查表明,多数高风险妇女的PGD有很少或根本没有的知识,强调需要更好的认识和教育方面潜在的生殖选项。使用PGD和IVF BRCA1 / 2突变携带者已成功分娩,但在公开发表的文献数据仍然非常有限。此外,PDG和辅助生殖BRCA突变携带者的长期安全性或结果有关的数据尚未公布。
遗传性非息肉病性大肠癌(HNPCC)或Lynch综合征
它是一种常染色体显性遗传性疾病的DNA错配修复系统。许多部门参考HNPCC林奇综合征,相信,HNPCC失败充分承认的重要性外的恶性肿瘤,如子宫内膜癌,卵巢癌,上消化道,泌尿道癌症与此疾病相关的。这种综合征占5-10%所有大肠癌和子宫内膜癌(29) 。Lynch综合征是由生殖系突变的一类负责修复某些类型的基因突变(29)的基因的发现,导致高风险家庭的连锁分析。这些基因被称为"错配修复基因和蛋白质产生校对DNA在复制过程中的正常和纠正错误。MSH2(MutS蛋白同源2)和MLH1(MutLł同源1)是最常见的突变不匹配这种综合征。修复基因MSH2和MLH1基因位于染色体2p16和3p21的。生殖系突变的其它错配修复基因(MSH6,PMS1,PMS2)已经确定,但在较低的频率 (29).
开发癌症是否有生殖系MLH1或MSH2突变的可能性:
| Cancer Type | Risk at Age 70 (%) |
| Colorectal carcinoma | 80 |
| Endometrial carcinoma | 42 |
| Gastric carcinoma | 19 |
| Biliary tract carcinoma | 18 |
| Urinary tract carcinoma | 10 |
| Ovarian carcinoma | 10 |
家庭历史的第一步是确定病人是否是一种遗传性疾病的风险增加。已经开发了一些比较严格的标准,来识别个人林奇综合征的风险高。大约30%的家庭履行贝塞斯达标准,将有50-92%的家庭符合Amsterdam标准生殖系DNA错配修复基因突变 (30),(31).
贝塞斯达HNPCC(见下文)的标准似乎是最敏感的预测错配修复基因突变在HNPCC家系 (30). - 下列任的:
- 大肠癌小于50岁;
- HNPCC相关癌同时或异时,无论年龄大小(大肠癌,子宫内膜癌,胃癌,卵巢癌,胰腺癌,输尿管,肾盂,胆道,皮脂腺和小肠)的存在;
- 在个别具体的组织学特征小于60岁的大肠癌。特点:肿瘤浸润淋巴细胞,Crohn's样淋巴细胞反应,粘液性/印戒分化,或髓质增长模式的;
- 大肠癌诊断中的一个或多个第一大肠癌亲属与一个未满50岁的诊断与HNPCC;
- 在两个或两个以上的第一或第二学位与HNPCC相关肿瘤的亲戚,不分年龄的大肠癌。
阿姆斯特丹Ⅱ标准(见下文)为HNPCC更具体的 (31). 以下:
- 大肠癌和/或子宫内膜癌或移行细胞癌,输尿管或肾盂癌小肠中至少有三个人在同一个家庭;
- 其中一名患者是一个另外两名患者的一级亲属; 疾病发生在至少两个其他家庭成员的;
- 诊断中的至少一个是在50岁之前;
- 诊断必须得到病理证实;
- 家族性腺瘤性息肉病被排除在外。
HNPCC /林奇综合征简单的风险评估工具
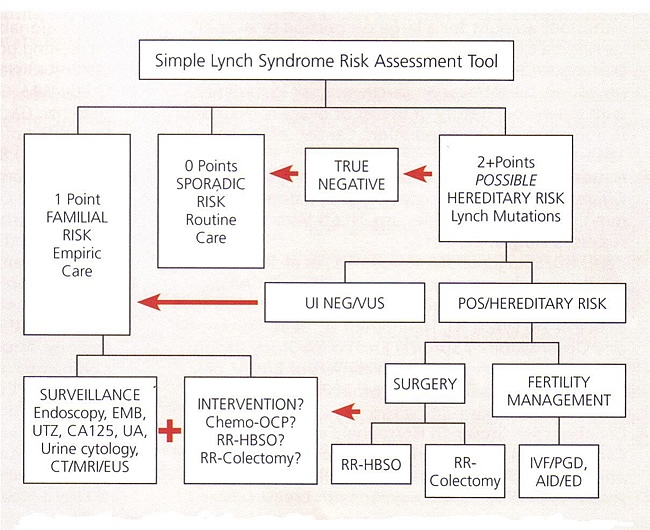
Abbreviations: AID, artificial insemination by donor; CA 125, cancer antigen 125; CT, computed tomography, ED, egg donation; EMB, endometrial biopsy; EUS, endoscopic ultrasound; HBSO, hysterectomy with bilateral salpingo-oophorectomy; IVF, in-vitro fertilization; MRI, magnetic resonance imaging; OCP, oral contraceptive pills; PGD, preimplantation genetic diagnosis; POS, positive; RR, risk-reducing; UA, urinalysis; UI NEG, uninformative negative; UTZ, ultrasound; VUS, variant of uncertain significance.
监控遗传性非息肉病性大肠癌(HNPCC)
当突变被确定,其他家庭成员可以执行一个更简单,成本更低,遗传分析。广泛的咨询建议之前和之后的测试。一旦遗传过程已经完成,患癌症的风险可以被指定为病人和她的家人。当突变已经确定,应提供基因检测的所有家庭成员。这些人应该进行遗传咨询,可以解释,使测试的优点和缺点。突变的携带者提供密集监控。如果没有突变的病人被识别,但他的家人符合Amsterdam标准的协议Lynch综合征,监视观察。在这组大肠癌的死亡率已被证明可以减少结肠镜检查(32) 。大多数权威人士认为,风险在这些患者的管理,减少子宫切除术,双侧输卵管卵巢切除术有一定的作用。HNPCC综合征的大肠癌发生于近端结肠,相对零星的情况下,往往更远端有一个倾向。建议预防性结肠切除息肉确定在一个年轻的年龄,也有息肉的患者,微卫星不稳定阳性或个人谁是无法进行定期监测与HNPCC基因突变患者。目前正在研究化学预防本组患者使用非甾体类消炎药,以防止结肠息肉,数据应该是即将举行的。如果这些患者正在探索的另一个原因是,应考虑给予辅导,对可能的风险和收益的全子宫切除术,双侧输卵管卵巢切除术。
| Tumor Site | Screening Modality (%) |
| Colon | Colonoscopy every 1-2 years starting at ages 25-30 |
| Endometrium | Ultrasonography every 1-2 years starting at ages 30-35; consider endometrial biopsy every 1-2 years |
| Ovary | Ultrasonography and CA 125 annually, starting at ages 30-35 |
| Upper urinary tract | Urine cytology every 1-2 years starting at ages 30-35 |
| Stomach | Gastroscopy every 1-2 years starting at ages 30-35, (when upper GI cancer occurs two or more times in a family) |
GI, gastrointestinal
李弗劳明综合征
李弗劳明综合征(LFS)与种系突变的肿瘤抑制基因TP53,导致高度渗透的倾向发展肉瘤和早发性乳腺癌,脑,肾上腺皮质,和其他癌症。带LFS的人有一个绝对的30岁约50%和90%的年龄在60岁发展任何癌症的风险。高达1%的乳腺癌在美国,这种癌症可以具有独特的表型,表达激素受体 和HER2/neu LFS帐户。从头突变频率估计为7%至20%,,TP53测试家族癌病史(34)在没有选择的患者可能是适当的。 (34).
考登综合征
Cowden综合征(CS)传达的易感性增加乳腺癌,甲状腺癌,子宫内膜癌,结肠癌,并影响多个器官的良性错构瘤。它是一种常染色体显性遗传有关中抑癌基因PTEN的突变。是常见的妇科恶性肿瘤的5-10%的子宫内膜癌的风险和25-50%患乳腺癌的风险(42) 。外在表现包括大头畸形和乳突状丘疹在脸上,口腔舌黏膜及四肢,几乎是无处不在的30岁。终生患乳腺癌的风险是25-50%,平均诊断年龄为38-46岁(35) 。子宫内膜癌风险的生命时间是5-10%(35) 。PTEN基因胚系突变的确定符合临床诊断标准的患者中约80%,几乎一半的人有没有家族病史的CS。的CS报告的次数是1,200,000中,但是很可能诊断(35) 。子宫内膜息肉反复发作,多预示着一个高风险的子宫内膜癌在妇女与CS。完成生育后恶性肿瘤监测和考虑全子宫切除术是必要的 (42).
遗传性弥漫性胃癌综合征
遗传性弥漫性胃癌综合征是与CDH1基因突变的特点是患胃癌的危险性(36) 80%的寿命。CDH1基因突变的妇女有高达60%的终身发展乳腺小叶癌的风险,但是,CDH1基因突变,发病年龄早或小叶乳腺癌家族史的妇女选择的患病率较低,约1%(36) 。其中弥漫性胃癌和乳腺小叶癌的家庭,CDH1基因突变被确定在25-50% (36).
黑斑息肉综合征
黑斑息肉综合征(PJS)STK11基因的改变,导致整个胃肠道的错构瘤性息肉,肠套叠,肠梗阻。STK11基因突变传达乳腺癌,卵巢癌,宫颈癌,胰腺癌,胃癌和结肠癌的风险增加癌症,除了良性性索肿瘤。40岁患乳腺癌的风险达到8%和32%,由60岁。STK11基因突变携带者的一半缺乏PJS家族病史的 (37).
神经纤维瘤病-1
神经纤维瘤病(NF-1)具有皮肤神经纤维瘤和恶性神经鞘瘤,学习障碍,以及在3000活产儿(38)的患病率为1 。NF-1的妇女最近的一项研究报告50岁之前患乳腺癌的风险增加5倍和3 - (38)一生中患癌症的风险增加4倍。.
推进标准的癌症护理
由于筛查遗传性癌症已成为更容易获得,很多周围的责任的问题,风险管理,病人安全已经出现。在所有的医疗和法律问题,这些领域普遍关注的有关标准照顾,文件,同意,患者的期望值,并跟进。许多供应商认为,遗传性癌症筛查是在基层医疗机构的护理标准。但是,也有三个点是非常重要的是记住。这是标准的护理取得全面和完整的家庭的历史和它在常规基础上更新。这是标准给予患者适当的信息的基础上,家族病史,以便他们能够作出明智的决策对他们的医疗护理。最后,它是标准的护理彻底和完全的记录,无论是与病人讨论。如果你坚持这三点,那么它似乎是遗传性癌症筛查,事实上,标准的护理。
文档:一旦你已经确定基因检测符合标准的人,需要多少文档?它是足够的,有您的笔记状态:"基因检测信息"或"小册子吗?" 虽然它是很高兴地看到你的计划,记录,它更重要的是要看到背后的推理计划。在这种情况下,扩大票据如:"根据家族史,基因检测的建议。病人明白,如果测试是积极的,有卵巢癌和/或乳腺癌或特定Lynch综合征癌的风险大幅增加您筛选]。" 虽然我们知道,我们讨论了癌症风险,患者可以很容易地矛盾,什么是不记录在他们的图表。患者可能会认为,如果他们理解他们的风险,他们会,当然,已经同意测试。走进你的办公室纳入某种跟踪系统是审慎的。这可以让你与病人的随访后,她被称为遗传咨询。没有这种类型的跟踪和跟进,一个令人不安的问题可以提出:"如果你觉得这是重要的,足以对病人有这个测试,为什么不是很重要,足以给你看,如果有人做过试验吗?"
知情同意知情同意或知情的拒绝时需要解决的讨论遗传风险评估。通常情况下,知情同意,只有处理与侵入性程序相关的风险告知患者。然而,有足够的知情同意包括膨胀。作为充分知情同意的一部分,我们现在要求给所有的治疗选择,以及每个选项的风险和好处。因此,如果我们不给予适当的患者基因检测的选项(以及其风险和收益),我们可能会同意的基础上有所疏忽,就应该有一种不良事件。这是明智的拒绝可能开始发挥作用,如果病人不想要做什么提供商认为是合适的,或没有跟进与遗传咨询转介,当你提到她一个,记录他们的拒绝,或缺乏后续,最终可能是更重要的记录他们的同意。知情拒绝医生做了什么是审慎的,是病人的选择,它不循的文件。许多国家共分疏忽的一些元素,这可以走了一步进一步,并记录病人的拒绝理由;测试结果的恐惧,不愿意做任何有关结果,或财政原因可能是病人的决定的一部分,以拒绝测试。
目前,违规个案的主要成因之一涉及与乳腺癌的问题。通常情况下,指控包括延迟诊断和故障诊断。我们现在看到一个新的指控,被称为一个失败的我们的"义务告知"或"责任警告"。这涉及到未能识别一种遗传性癌症的风险,因此,增加监控已经实施的早期诊断癌症,或降低风险的预防性手术病人可能已经完成。这些类型的案件,将是非常困难的,如果不是不可能,保卫没有适当的文档,包括病人的拒绝测试,文档和文件的解释非常具体的癌症风险。
总结
估计超过30万美国妇女携带继承患乳腺癌和卵巢癌的风险高。日益广泛的基因测试是可用来定义病人的风险,但结果仍可能证明是不确定的或复杂的解释。癌症遗传学专业人士提供全面的风险评估,咨询和管理建议患者和家属患乳腺癌和卵巢癌具有遗传倾向。遗传风险评估作为妇女的健康专家,是我们的责任。集中家族史应该是所有患者的初步评估的一部分。母亲和父亲的血统,应当建立包括至少三代(病人,她的父母,她的祖父母代)。关于家庭成员的年龄在两个乳房,如乳腺癌诊断和额外的细节信息是非常有用的。家族史的更新应询问年度考试,因为增加和新的诊断可能会改变最初的建议,关于基因检测。遗传风险评估建议患者具有更大的比约20-25%的乳腺癌和卵巢癌具有遗传倾向的机会。BRCA1或BRCA2基因突变的妇女应给予降低风险的输卵管卵巢切除术的40岁或生育时是完整的。对于降低风险的双侧输卵管卵巢切除术,卵巢和输卵管的所有组织应该被删除。应该进行彻底的腹膜与盆腔洗涤表面可视。卵巢和输卵管的完整,连续切片是必要的,隐匿癌镜检。
参考文献
- Robson ME, Boyd J, Borgen PI, et al. Hereditary-breast cancer. Curr Probl Surg 2001;38(6):387-480
- Risch HA, McLaughlin JR, Cole DC, et al. Population BRCA1 and BRCA2 mutation frequencies and cancer penetrances: a kin-cohort study in Ontario, Canada. J Natl Cancer Inst 2006;98(23):1694-1706
- Dominguez FJ, Jones JL, Zabicki K, et al. Prevalence of hereditary breast/ovarian carcinoma risk in patients with a personal history of breast or ovarian carcinoma in a mammography population. Cancer 2005;104:1849-1853
- National Comprehensive Cancer Network. NCCN Guidelines: Genetic/Familial High-Risk Assessment: Breast and Ovarian Cancer. Available at: http://www.nccn.org/professionals/physician_gls/pdf/genetics_screening.pdf Accessed 7 December 2012
- Reedy M, Gallion H, Fowler JM, et al. Contribution of BRCA1 and BRCA2 to familial ovarian cancer: a gynecologic oncology group study. Gynecol Oncol 2002;85:255-259
- Gudmundsdottir K, Ashworth A. The roles of BRCA1 and BRCA2 and associated proteins in the maintenance of genomic stability. Oncogene 2006;25:5864-5874. (Level III)
- Venkitaramen AR. Cancer susceptibility and the functions of BRCA1 and BRCA2. Cell 2002;108:171-182. (Level III)
- Karlan BY, Berchuck A, Mutch D. The role of genetic testing for cancer susceptibility in gynecologic practice. Obstet Gynecol 2007;110:155-167
- Antoniou A, Pharoah PD, Narod S, et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet 2003;72:1117-1130. (Level III)
- Metcalfe KA, Lynch HT, Ghadirian P, et al. The risk of ovarian cancer after breast cancer in BRCA1 and BRCA2 carriers. Gynecol Oncol 2005;96:222-226. (Level II-3)
- Lakhani SR, Manek S, Penault-Llorca F, et al. Pathology of ovarian cancer in BRCA1 and BRCA2 carriers. Clin Cancer Res 2004;10:2473-2481. (Level II-3)
- Levine DA, Argenta PA, Yee CJ, et al. Fallopian tube and primary peritoneal carcinomas associated with BRCA mutations. J Clin Oncol 2003;21:4227-4227. (Level III)
- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin. Hereditary breast and ovarian cancer syndrome. Number 103, April 2009
- National Comprehensive Cancer Network. Genetic/familial high-risk assessment: breast and ovarian. NCCN Clinical Practice Guidelines in Oncology. V.1.2008. Fort Washington (PA): NCCN; 2008. (Level III)
- Olivier RI, Lubsen-Brandsama MA, Verhoef S, et al. CA 125 and transvaginal ultrasound monitoring in high-risk women cannot prevent the diagnosis of advanced ovarian cancer. Gynecol Oncol 2006;100:20-26. (Level II-3)
- Whittemore AS, Balise RR, Pharoah PD, et al. Oral contraceptive use and ovarian cancer risk among carriers of BRCA1 or BRCA2 mutations. Br J Cancer 2004;91:1911-1915
- Rebbeck TR, Lynch HT, Neuhausen SL, et al. Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations. N Engl J Med 2002;346:1616-1622
- King MC, Marks JH, Mandell JB. The New York Breast Cancer Study Group. Breast and ovarian cancer risks due to inherited mutations in BRCA1 and BRCA2. Science 2003;302:643-646
- Kauff ND, Satagopan JM, Robson ME, et al. Risk-reducing salpingo-oophorectomy in women with a BRCA1 or BRCA2 mutation. N Engl J Med 2002;346:1609-1615
- Karlan BY. Defining cancer risks for BRCA germline mutation carriers: implications for surgical prophylaxis. Gynecol Oncol 2004;92:519-520. (Level III)
- Lu KH, Kauff ND. Does a BRCA mutation plus tamoxifen equal hysterectomy? Gynecol Oncol 2007;104:3-4. (Level III)
- Satagopan JM, Boyd J, Kauff ND, et al. Ovarian cancer risk in Ashkenazi Jewish carriers of BRCA1 and BRCA2 mutations. Clin Cancer Res 2002;8:3776-3781. (Level II-3)
- Eisen A, Luinski J, Klijn J, et al. Breast cancer risk following bilateral oophorectomy in BRCA1 and BRCA2 mutation carriers: an international case-control study. J Clin Oncol 2005;23:7491-7496
- Walsh T, Casadei S, Coats KH, et al. Spectrum of mutations in BRCA1, BRCA2, CHEK2, and TP53 in families at high risk of breast cancer. JAMA2006;295:1379-1388. (Level III)
- Rodriquez E, Domchek SM. The prevention of hereditary breast cancer. Semin Oncol 2007;34:401-405. (Level III)
- Kauff ND, Mitra N, Robson ME, et al. Risk of ovarian cancer in BRCA1 and BRCA2 mutation-negative hereditary breast cancer families. J Natl Cancer Inst 2005;97:1382-1384. (Level II-3)
- Offit K, Kohut K, Claggett B, et al. Cancer genetic testing and assisted reproduction. J Clin Oncol 2006;24:4775-4782
- Offit K, Sagi M, Hurley K. Preimplantation genetic diagnosis for cancer syndromes: a new challenge for preventive medicine. JAMA 2006;296:2727-2730
- Lynch HT, Wastson P, Shaw TG, et al. Clinical impact of molecular and genetic diagnosis, genetic counseling, and management of hereditary cancer. Part I: Studies of cancer in families. Cancer 1999;86:2449-2456
- Hendriks YM, de Jong AE, Morreau H, et al. Diagnostic approach and management of Lynch syndrome (hereditary nonpolyposis colorectal carcinomas): a guide for clinicians. CA Cancer J Clin 2006;56:213-225
- Syngal S, Fox EA, Eng C, et al. Sensitivity and Specificity of clinical criteria for hereditary non-polyposis colorectal cancer associated mutations in MSH2 and MLH1. J Med Genet 2000;37:641-645
- Jarvinen HJ, Aarnio M, Mustonen H, et al. Controlled 15-year trial on screening for colorectal cancer in families with hereditary nonpolyposis colorectal cancer. Gastroenterology 2000;118:829-834
- Hampel H, Frankel W, Panescu J, et al. Screening for Lynch syndrome (hereditary nonpolyposis colorectal cancer) among endometrial cancer patients. Cancer Res2006;66:7810-7817
- Gonzalez KD, Buzin CH, Noltner KA, et al. High frequency of de novo mutations in Li-Fraumeni syndrome. J Med Gent 2009;46(10):689-693
- Zhou XP, Waite KA, Pilarski R, et al. Germline PTEN promoter mutations and deletions in Cowden/Bannayan-Riley-Ruvalcaba syndrome result in aberrant PTEN/ protein and dysregulation of the phosphoinsositol-3-kinase/Akt pathway. Am J Hum Genet 2003;73(2):404-411
- Schrader KA, Masciari S, Boyd N, et al. Germline mutations in CDH1 are infrequent in women with early-onset or familial lobular breast cancer. J Med Gent 2011;48(1):64-68
- Lim W, Olschwang S, Keller JJ, et al. Relative frequency and morphology of cancers in STK11 mutation carriers. Gastroenterology 2004;126(7):1788-1794
- Sharif S, Moran A, Huson SM, et al. Women with neurofibromatosis 1 are at a moderately increased risk of developing breast cancer and should be considered for early screening. J Med Genet 2007;44(8):481-484
- Pearlman MD. Ideal risk reduction management for women with BRCA gene mutations. Obstet Gynecol 2013;121:4-6
- Kwon JS, Tinker A, Pansegrau G, et al. Prophylactic salpingectomy and delayed oophorectomy as an alternative for BRCA mutation carriers. Obstet Gynecol 2013;121:14-24
- Mecalfe KA, Birenbaum-Carmeli D, Lubinski J, et al. International variation in rates of uptake of preventive options in BRCA1 and BRCA2 mutation carriers. Int J Cancer 2008;122:2017-2022
- Kalin A, Merideth MA, Regier DS, et al. Management of reproductive health in Cowden Syndrome complicated by endometrial polyps and breast cancer. Obstet Gynecol 2013;121:461-464
发布时间: 3 May 2013
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


