乳腺癌风险评估
WHEC实践公报和临床管理指南为医疗保健提供者。 教育补助金由妇女的健康和教育中心巡逻艇(WHEC)。
乳腺癌生物学是一个密集的研究课题,并出现了近年来的巨大突破。科学为雌激素受体生物学洞察力,导致雌激素,有针对性的预防和治疗的重大进展。增加乳房密度已经成为一种新的乳腺癌妇女后来的发展中占主导地位,检测,以及改变的危险因素。增加的因素,如乳腺密度更成熟女性的癌症,风险,可确定在中年。增强成像技术,如数字化乳腺摄影与磁共振成像,可以部署在更小的高风险妇女小组有效地达成不仅成本效益更加平衡和适当的比例,而且还损害受益。这是不审慎的乳腺X光依靠"解决"对乳腺癌的早期检测问题。乳腺癌风险评估,主要是妇女的日常保健方面,以及3个型号,可帮助临床医生这个任务:盖尔,克劳斯,和泰里尔,库齐克。第四个 - 和日益常见的基因测试工具,它可以是某些个人的遗传风险评估的一个重要部分。该模型可用于临床评估一个人患乳腺癌的风险会产生各种不同的估计,和临床医生必须了解每个模型的局限性,为他们的病人选择最合适的型号。
这个文件的目的是讨论现有的评估女性乳癌风险和运用各种工具,在临床实践中的临床应用。这次审查还提供了一个作为乳腺癌发展的主要危险因素的全面检查乳房密度的重要性,强调了遗传学和激素的作用,在维护妇女在绝经后乳腺密度播放。未来的研究,可对原有的的条件,如基因突变(检测)是放在高度侵略性癌症风险的妇女。基因检测在这里进行审查的建议,从而对遗传咨询的组成部分,特别着重个人识别测试,测试结果和解释。
背景:
终身癌症患乳腺癌的女性平均约为12% (1) 乳腺癌的危险因素为很好地描述。作者:(外源激素雌激素和孕激素的使用)是众所周知的风险增加,激素和内源性因素,如在月经初潮,绝经年龄,首次生育是一个轻微的关联,但意义重大,在患乳腺癌的风险增加。环境因素,如饮食和酒精的使用,虽然没有很好的理解,也与乳腺癌的风险。有过乳房活检,特别是一活检,表明小叶非典型增生或肿瘤,是癌症与乳腺癌有关的重大风险 (2) 一个癌症家族史也表明一个人的遗传组成部分的风险。这些因素有很多已纳入下面讨论的模式。乳房是由三个主要组织 - 脂肪,纤维/结缔组织和上皮组织。在这些组织中的相对含量的差异导致彼此在对乳房X光检查乳房X线的外观个人变异。脂肪是射线和X光出现在黑暗中,而上皮细胞和结缔组织的无线电密集,出现在乳房摄影灯。乳房X线密度(多动症)反映了对乳房X光检查乳房外观,显示了X线密度,即白色或浅的乳房地区的相对比例。增加乳房密度与一个高风险的一个乳房X光检查乳腺癌阅读困难的独立的增加 (3) 。
白人妇女有更大的发展比黑人妇女乳癌(虽然黑人妇女诊断出乳腺癌的风险更可能死于该病)。乳腺癌的其他危险因素已被发现或建议,但没有患乳腺癌的风险评估工具包括以下几个原因:因为证据表明,这些因素导致患乳腺癌的风险是不是决定性的,因为研究人员不能确定是否这些因素加起来有用的信息的因素已在该模型,或因其他危险因子的数据没有提供用于开发模型的研究数据。这些风险因素包括:在绝经年龄,使用避孕药,高身体质量指数,高脂肪的饮食,酒精,辐射暴露和环境污染物。最近发表的研究显示,乳房组织密度,乳房摄影测量的,可以添加有用的资料,但密度与乳腺癌风险模型测量组织仍然需要更多的独立研究与验证 (3) 。 研究还表明,其他风险因素,如激素疗法,可改善工具。
简介:
患乳腺癌的风险评估工具是为妇女在美国人口的年龄35岁以上 (4) 。它不应该被用于女性的乳癌,霍奇金淋巴瘤的暴露,或妇女住在谁,或最近的,与低乳腺癌风险,如中国或日本农村,地区迁移治疗妇女乳腺放射诊断前。 BRCA1和 BRCA2更准确的方法,项目风险可能会为妇女提供与某些基因突变罕见的确定,变更等在乳腺癌的易感性。患乳腺癌的风险评估工具的开发,并已在人口为主的非西班牙裔白人妇女进行了验证。需要更多的研究来验证和完善对其他种族和族裔群体模式。患乳腺癌的风险评估工具,是计算机程序,是由美国国家癌症研究所的科学家和国家外科辅助乳房及胃肠计划(综合NSABP),以协助他们在讨论女性患者患乳腺癌的风险医疗机构发展。该工具允许一个健康专业项目在一段时间5年期女性患乳腺癌的风险比个人的估计,并比较其一生与一个同龄女子的平均风险妇女的风险计算。患乳腺癌的风险评估工具,可发现: http://www.cancer.gov/bcrisktool 。
理解风险因素:
虽然这些模型提供了每一个短期和长期的风险,可以终身使用风险的风险估计的比较每个模型产生。对每个模型的局限性的理解将使临床医生使用风险评估和辅导在特定情况下一个女人最合适的型号。有关信息,以帮助您了解癌症患者的危险访问http://understandingrisk.cancer.gov 。这个互动网站将帮助你的病人就如何降低风险的决策。
Gail模式:
该模型集成(5) :
- 年龄 - 随着年龄的发展乳腺癌的危险增加。乳腺癌的大多数病例发生在50岁以上女性。
- 受影响的一级亲属号码 - 拥有一个或多个学士学位血液谁一直与乳腺癌的发展增加一个女人的疾病的机会确诊的亲属。
- 初潮年龄 - 妇女谁了他们的第一个12岁前月经期有轻微增加患乳腺癌的风险。
- 在首次生育的年龄 - 风险取决于年龄,首次生育和家庭乳腺癌史,如在下面的相对危险度如下表所示。
- 过去数乳腺活检 - 谁曾乳房活检妇女的乳房癌,特别是如果活检显示,非典型增生的乳腺组织称,更改的风险增加。这些妇女是因为在没有任何提示,因为自己的活检切片,风险增加。
- 活检标本中存在的不典型增生 - 两个乳房组织异常 - 导管原位癌(DCIS的)和小叶原位癌(集装箱检查系统),是同为发展中国家浸润性乳腺癌的风险增加。
相对患乳腺癌的风险
| 在首次生育年龄 | #受影响的亲属 | ||
| 0 | 一 | 2个或更多 | |
| 20岁以下 | 一 | 2.6 | 6.8 |
| 20 - 24 | 1.2 | 2.7 | 5.8 |
| 25 - 29或没有孩子 | 1.5 | 2.8 | 4.9 |
| 30岁以上 | 1.9 | 2.8 | 4.2 |
对于0或1的影响相对的,风险随着年龄的增加首次生育的妇女。对于有2个或以上的直系亲属,随着年龄下降的风险在首次生育的妇女。这个模型并不能解释为家庭亲人的母亲和妹妹比其他的历史。重要的是,盖尔模型没有考虑乳腺癌家族病史的父亲。该模型预测,5年或预期寿命为乳腺癌的风险。
新模型可用于项目超过500,10,20和30年为间隔的风险。新模型预测乳腺癌高风险,高密度比以前的型号中的妇女,和以前的分析表明,新模型具有较高的准确性温和(6)。独立之前,需要验证的研究,这种模式应为辅导使用,才作出永久性改变,乳腺癌的风险评估工具。
克劳斯型号:
癌症的历史,这因素在乳腺癌中高达2第一和/或第二学位或父系亲戚和母亲的癌症年龄,这些人被诊断为乳腺癌(7) 。这一信息是用来计算目前的年龄和寿命风险基础的风险。
终身风险乳腺癌家族病史的基础上:克劳斯模型(8)
| 癌症的发病年龄相对 | ||||||
| 20 - 29 | 30 - 39 | 40 - 49 | 50 - 59 | 60 - 69 | 70 - 79 | |
| 一个首当其冲的直系亲属 | 0.211 | 0.165 | .132 | 0.110 | 0.096 | 0.088 |
| 一个受影响的第二度相对 | 0.142 | 0.120 | 0.104 | 0.094 | 0.094 | 0.083 |
| 两个受影响的一级亲属 | ||||||
| 在第一次发病年龄相对影响 | 发病年龄的影响相对第二 | |||||
| 20 - 29 | 0.484 | 0.460 | 0.434 | 0.397 | 0.354 | .308 |
| 30 - 39 | 0.460 | 0.437 | 0.399 | 0.353 | 0.302 | 0.252 |
| 40 - 49 | 0.434 | 0.399 | 0.354 | .300 | 0.246 | .200 |
| 50 - 59 | 0.397 | 0.353 | .300 | 0.245 | 0.195 | 0.158 |
| 60 - 69 | 0.354 | 0.302 | 0.246 | 0.195 | 0.156 | 0.128 |
| 70 - 79 | .308 | 0.252 | .200 | 0.158 | 0.128 | 0.109 |
| 两个受影响的二级亲属 | ||||||
| 在第一次发病年龄相对影响 | 发病年龄的影响相对第二 | |||||
| 20 - 29 | 0.262 | 0.256 | 0.245 | 0.231 | 0.211 | 0.189 |
| 30 - 39 | 0.256 | 0.245 | 0.230 | .200 | 0.186 | 0.162 |
| 40 - 49 | 0.245 | 0.230 | 0.209 | 0.184 | 0.159 | 0.137 |
| 50 - 59 | 0.231 | .200 | 0.184 | 0.158 | 0.135 | 0.117 |
| 60 - 69 | 0.211 | 0.186 | 0.159 | 0.135 | 0.116 | 0.103 |
| 70 - 79 | 0.189 | 0.162 | 0.137 | 0.117 | 0.103 | 0.094 |
| 一个受影响的第一和第二度相对 | ||||||
| 发病年龄在一级亲属 | 发病年龄在第二度相对 | |||||
| 20 - 29 | 0.450 | 0.433 | 0.407 | 0.369 | 0.320 | 0.264 |
| 30 - 39 | 0.437 | 0.414 | 0.377 | 0.329 | 0.274 | 0.219 |
| 40 - 49 | 0.417 | 0.383 | 0.338 | 0.281 | 0.225 | .177 |
| 50 - 59 | 0.388 | 0.343 | 0.289 | 0.233 | 0.182 | 0.143 |
| 60 - 69 | 0.349 | 0.296 | 0.239 | 0.188 | 0.148 | 0.120 |
| 70 - 79 | 0.305 | 0.248 | 0.196 | 0.154 | 0.124 | 0.105 |
在泰里尔-库齐克型号:
目前,一个研究工具,试图解决一个风险因素,包括各种限制由以前的型号(9) 。该模型使用的年龄,身体质量指数(BMI),荷尔蒙和生殖因素,乳腺疾病,以及广泛的家族历史,计算个人患乳腺癌的风险。一项研究表明,该模型制作了乳腺癌的比例较高预期的遵守情况下,比当时的盖尔和圣诞老人模型,表明它可能会产生一个更准确的风险评估(10) 。这种模式尚未得到验证,因此,可用于临床上谨慎。
遗传性乳腺癌和卵巢癌综合征
约5%至10%的癌症是遗传性乳腺癌,15%至20%的病例可能与乳腺癌有家族组成部分,从基因相互作用的结果,环境(11) 。虽然BRCA1和 BRCA2的基因是最常见的筛选,他们很可能不是唯一的基因在家族性乳腺癌患者牵连:在多达70%的病例的,检测结果阴性的人在一个家庭中最有可能产生一个遗传性癌症。BRCA1和BRCA2基因突变与一个45%至85%终身致癌风险的乳房年,平均发病年龄43对BRCA1和BRCA2的 45年(12) 。 BRCA1和 BRCA2两个是同一个> 50%的癌症风险的第二个原发性乳腺癌。癌有关的BRCA1是一生的风险与卵巢45%,而BRCA2基因的一半,风险(13) 。研究人员发现癌症的地区与BRCA2基因的卵巢是利率较高的相关,在临床实践中,然而,在每个基因都突变是有害的致癌风险给予类似的速度。突变的BRCA1或 BRCA2的家庭有前列腺癌的风险增加。突变携带BRCA2基因在胰腺癌是男性乳腺癌的风险,以及,喉,及胆囊/胆道癌,黑色素瘤(13)。突变BRCA1和 BRCA2的患病率估计为1 300至800之间的遗产的人对欧洲犹太人的遗产和1 40人的德系。遗传年检测BRCA1和 BRCA2,它可用于在临床,涉及到删除的整个评价每个基因编码区的大型搜索。基因检测可以解读复杂,特别是如果确定的遗传改变的意义是不确定的。在这种情况下,突变被称为不确定意义"变种",不能用于其他家庭成员的测试。
2009年,美国妇产科学院的妇产科学会(ACOG)发表了一份建议,即基因突变的妇女以20%至25%的几率有BRCA2基因BRCA1或一个接受基因检测的风险评估,并考虑遗传(14) 。 ACOG的进一步确定谁妇女有BRCA1或BRCA2基因突变作为评估潜在候选人的遗传危险一%的风险5%至10。 2009年在女性的基因检测ACOG的建议如下:
- 遗传风险评估,建议妇女以20%至25%的突变机会窝藏一BRCA基因 :
- 妇女的乳腺癌和卵巢都癌症的个人历史;
- 妇女卵巢癌和卵巢癌密切相关/或停经前乳癌;
- 妇女卵巢癌谁是德系犹太人血统的;
- 妇女患乳腺癌的年龄<50年,更紧密地与卵巢癌或乳腺癌的男性亲属在任何年龄;
- 德系犹太人血统的妇女在其中乳腺癌是在年龄<40年来诊断;
- 妇女密切相关的一个已知的突变BRCA1或BRCA2基因 。
- 妇女,其基因突变的几率窝藏1%的BRCA基因的5%和10也可能受益于遗传风险筛查:
- 与乳腺癌的妇女在年龄<40年;
- 卵巢癌,原发性腹膜癌,或高年级,浆液性癌组织学输卵管妇女在任何年龄;
- 双侧乳腺癌(尤其是如果对乳腺癌的第一例是在年龄<50年诊断妇女);
- 妇女在年龄<50年,一个与乳腺癌密切相关的年龄<50岁乳腺癌;
- 德系犹太人血统的妇女患有乳腺癌的年龄<50年;
- 与乳腺癌的妇女在任何年龄和"> 2近亲在任何年龄(特别是如果至少有一个乳腺癌病例在年龄<50年来诊断)与乳腺癌;
- 与近亲符合以前的标准之一不受影响妇女。
在一个完整的系谱分析的价值:
由于BRCA1和 BRCA2是与癌症相关的一个品种,病人应询问所有已知的癌症和亲属之间在诊断时的年龄。患者也应特别要求对癌症目前在第二和第三级亲属(祖父母,阿姨,叔叔,表兄弟和第一),因为这些信息可能是在确定一个常染色体显性遗传模式有帮助。重要的是要捕捉父母家族病史,并询问收养。有些情况可能掩盖了遗传性乳腺癌和卵巢癌家族史。谁的亲戚有一子宫切除术或卵巢切除术已大大减少了以往有乳腺癌或卵巢癌的机会。家庭规模和性别分布,亦会影响家庭的遗传性癌症的患病率在一,如家庭妇女很少有一个非常小的数名成员谁很可能表达表型 (15)。 最后,常常是有帮助的审查家庭成员的医疗记录,以发展,因为不是所有的妇科癌症的遗传性癌症家族病史,在这方面是平等的。
解读遗传结果:
一个在遗传性癌症基因检测的主要原则是测试在家庭中谁是最有可能是癌症的人。在一些家庭,该人是一个谁也被赋予了对乳腺癌的诊断相对的。测试软件的人可以决定是否在一个家庭中存在突变,建立一个背景来解释的亲属基因测试结果。如果一个家庭是已知的基因突变,然后解释另一考验是相对简单:一个相同的突变阳性检测结果与癌症风险增加有关。负的结果意味着,该病人的平均发病率是,她的家族历史,是关系到一个,她没有继承突变的存在。
病人管理后,不确定的结果:
以下方案说明癌症困难的家庭,历史解释负的BRCA1 / 2的结果,但没有已知的突变。
方案1:
病人甲是在年龄41岁诊断患有乳腺癌。她的妹妹被诊断为年龄52岁,卵巢癌。病人甲是突变的人在这个家庭最有可能遗传,但测试表明,她是BRCA1和 BRCA2阴性。
释义:此测试不排除在这个家庭遗传性癌症。它也无法排除病人A的卵巢癌的风险,因为她的家庭历史。因此,基因测试是不确定的。风险评估和管理计划,为患者甲应根据她的家庭历史。
n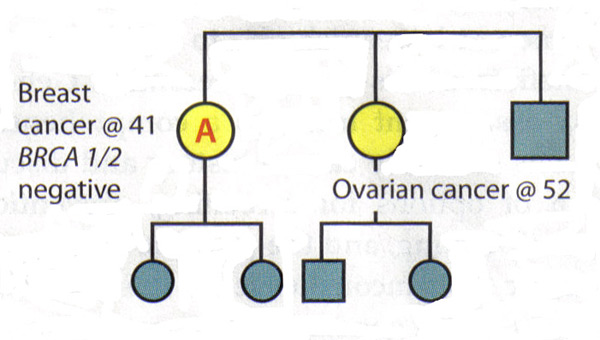
方案2:
病人乙的已故母亲和姨母被诊断患有乳腺癌和卵巢癌,分别为。患者乙要求遗传性癌症基因检测-家庭首次在这样做-并发现她是BRCA1和 BRCA2阴性。
释义:通过本身,这一结果是不确定的。如果她的母亲有一个突变,那么将有可能由此得出结论认为病人乙的平均风险为负的结果。不过,由于她的母亲和姑姑的地位是未知的,它不再是可以测试他们来说,这一结果的解释是不清楚。可能没有一个在家庭突变或有可能是基因突变,病人乙没有继承。另外,测试可能没有做正确,或有可能是在一个或BRCA2突变基因BRCA1的除外。因此,病人乙的管理应根据她的家庭历史。
n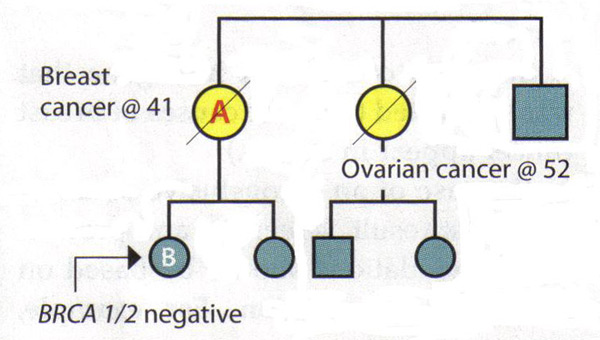
遗传性乳腺癌的成因:
以个人的负面结果可能意味着几件事情:
- 可能没有在家庭突变;
- A突变可能存在的人不继承;
- 测试可能没有被正确执行;
- A突变可能存在于一个没有测试基因(见下面的乳腺癌遗传原因)
| 综合症 | 基因 |
| 乳腺癌和卵巢癌的遗传 | BRCA1基因/ 2 |
| 李弗劳梅尼综合征 | p53基因 |
| 考登综合征 | PTEN基因 |
| 遗传性非息肉病性大肠癌 | MLH1/MSH2 |
| Muir - Torre征候群 | MLH1/MSH2 |
| 黑斑息肉综合征 | STK11 |
| 共济失调毛细血管扩张症 | 自动柜员机 |
X线乳腺密度(多动症)和乳腺癌的风险
乳房X线密度(多动症)反映了对乳房X光检查乳房外观,显示了X线密度,即白色或浅的乳房地区的相对比例。几种分类方案已被用于分类数十年万桶。最早的分类是沃尔夫的实质模式,分类型的密度分为4类的范围和 (16) :
- N1的:非致密,无可见的管道;
- 小一:突出导管模式占用不到四分之一的乳腺癌;
- 小二:突出导管模式比一的乳房第四以上;及
- 邓亚萍:均匀,密度斑块样的地区。
目前,最常见的密度的临床措施是乳腺影像报告和数据系统(双向回返数据库)密度法,放射学学院提出的美国 (3) (17)毕,回返数据库密度是一种主观衡量放射用来作为乳房X光检查分类如下:
- D1的:脂肪;
- 第二天:散乱密度;
- 维生素D3:多相密集;或
- D4类:极浓。
电脑辅助方法用于定量估计MBD的措施,其中包括百分之密度(局部放电的百分比,显示整体乳房组织密度),绝对的密集区和非密集区 (3)。 (16)。
多动症与乳腺癌风险:
高架多动症被认为是癌症的一个因素乳腺癌的最大风险,无论是作为一个绝对的衡量评估或定量 (16)。 在乳腺密度最高的类别妇女有4 - 6倍增加乳腺癌的风险比女性在最低类别。多动症已被证明是一个强大和遗传突变等风险因素除了年龄乳腺癌比 (16)。 作者:多动症和乳腺癌的关系已出现在老年人和年轻妇女都接受筛检乳房摄影,以及在高加索和非白人人口。
MBD的激素的影响:
有强烈和一致的证据表明,多动症是受激素在月经初潮年龄的因素,如更年期,第一胎的年龄,胎次,并利用外源激素 (18)多动症的影响外源激素对是最好的说明了积极的多动症协会与绝经后激素(玛嘉烈医院)和他莫昔芬治疗逆协会 (18) 这些协会是重要的,因为他们建议应在MBD的变化,表现差,可能转化为乳腺癌激素疗法的风险间的个体差异。随着雌激素在绝经枯竭,乳房腺体组织经历倒退。这也反映了多动症减少绝经期间和之后。当过程是研究中断玛嘉烈医院,定量评价MBD的措施表明,这些激素是MBD的关联%的绝对增加3%至6 (19)。 在挪威的乳腺癌普查计划 (19)。 玛嘉烈医院治疗当前用户有显着较高的平均百分比趋势多动症的 P比不使用者(用户从未<.001)。同样,绝经后雌激素/孕激素干预(佩皮)试验中,研究了MBD的交往和玛嘉烈医院,也看到了与联合激素治疗增加 (20)。 在妇女健康倡议(WHI)这项研究中,妇女被随机分派接受每天结合共轭雌激素(中东欧,0.625毫克),加上醋酸甲羟孕酮(MPA的,2.5 mg)或安慰剂。超过75%的妇女主动玛嘉烈医院增加了1多动症 (18)。 总而言之,这些研究表明,在常规剂量雌激素和孕激素结合疗法是与增加乳房密度,不论孕激素管理模式。而且,重要的是,改变平行与MBD的协会,这些协会的风险疗法与乳腺癌,癌症等有增加乳腺癌的综合治疗,但不单独与雌激素 (21)。 虽然低剂量治疗方案是希望能有少乳房密度影响的研究,最近没有发现差异协会的常规和低剂量荷尔蒙疗法与骨密度 (22)。 1至2个月的停止了相关的跌幅,多动症只是小,治疗期间和停止这短暂并不影响乳房X光检查召回率 (23)。
n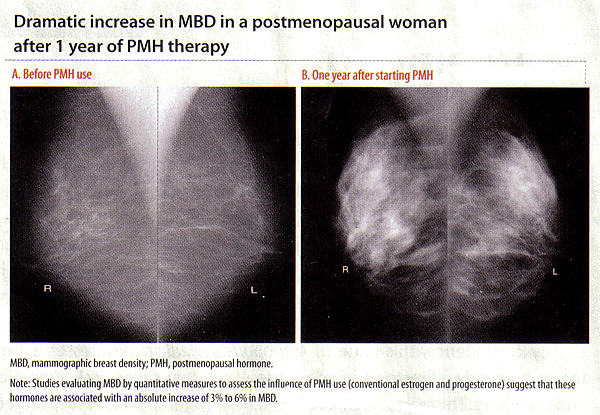
影响他莫昔芬,雷洛昔芬,并MBD的芳香酶抑制剂:
是在玛嘉烈医院和多动症之间,呈正相关的逻辑问题的看法是否他莫昔芬,雷洛昔芬或芳香酶抑制剂减少万桶。
他莫昔芬:是一种选择性雌激素受体调节剂(SERM)的竞争性结合雌激素受体和雌激素的合成块。对乳腺癌抗雌激素的影响导致其作为辅助内分泌治疗的妇女与雌激素受体阳性绝经后乳腺癌患者使用。他莫昔芬也被用来作为化学预防剂,以减少高风险的妇女患乳腺癌的风险。在国家外科辅助乳房及胃肠计划(综合NSABP)随机高风险的妇女,5年他莫昔芬治疗的临床试验结果表明,减少50%的浸润性乳腺癌的风险,49%,非侵入性乳腺癌的风险比服用安慰剂 (24)。 有几项研究审查了他莫昔芬对多动症多动症和使用效果有不同的预测方法研究人群(即与已知的辅助他莫昔芬或妇女乳腺癌妇女的乳癌高风险的化学预防他莫昔芬)。这些研究表明,一直在他莫昔芬的妇女做的经验,有统计上MBD的显着减少。其中一些研究指出,百分之跌幅MBD的妇女在绝经后发生更大的频率比绝经前 (24)。 这些研究共同的全部是事实,并非所有的妇女经历了他莫昔芬在乳腺癌治疗与密度降低,妇女的比例经历了密度降低介于21%至80%。这是整个研究时间与不同的MBD的估计方法,人群(无论是高风险的妇女或癌症例),如上所述,不同绝经状态。这表明,在多动症的假设他莫昔芬诱导的妇女比例下降有临床意义,在高危妇女乳腺癌复发或对侧活动中的案件较少的情况较少发生癌症的产生。这些妇女的立场,受益于他莫昔芬剩余。相反,那些谁看到几乎没有减少,甚至在MBD的增加可能是那些将受益于谁的替代治疗方法。
雷洛昔芬:花药变换SERM剂已用于癌症化学预防乳腺癌由于减少侵入性乳腺癌中表现出的风险治疗后5年 (23)。 一些研究表明雷洛昔芬的使用多动症多动症类似跌幅雷洛昔芬的妇女相较于安慰剂,其中显示在别人的微小变化 (25)。 在雷洛昔芬的研究和多动症从全场乳房体积密度评估数字图像,它显示在雷洛昔芬组(中位数为-4.1%,95%CI为-6.9%-2.1%的体积减少多动症小),与此相比MBD的增加在 p出现在低剂量玛嘉烈医院组(中位数15.0%,95%CI为4.8%〜28.6%; <.0001)。
芳香酶抑制剂(认可):人类乳腺肿瘤块地方提取合成雌激素,目前是最有效的乳腺癌内分泌治疗雌激素受体阳性绝经后。很少有研究结果喜忧参半审查认可机构,来曲唑和多动症。这些研究包括他莫昔芬106年来曲唑或安慰剂治疗绝经后妇女在5谁要么随机;这项研究没有发现多动症之间的差异变化后2组的9至15个月 (26)。 雷洛昔芬的认可机构与多动症研究的结果不一致的可能与希望,这些疗法是绝经后的妇女,以往只在较低的基线MBD的事实,使硬盘的微小变化来检测。然而,大型研究与精心调整密度和后续措施为乳腺癌,这些都是需要确定是否多动症,可作为这些生物标志物及其他内分泌疗法使用。
多动症的临床应用和乳腺癌风险:
最近的研究纳入改进的C -统计量由0.01至0.06的BI -回返数据库和定量MBD的措施,把一些乳腺癌预测模型,并取得了改善癌症的风险预测的风险() (27)。 一个带有多动症措施增强模式,因此,最好的模式,但目前现有的盖尔为个性化的风险依然贫困。此外,重要的是要认识与评价与妇女乳房X光有关的临床挑战,增加多动症,包括乳房X光摄影及乳房活检重复和检测临床意义的异常困难的需要。由于外源激素之间以及在多动症,一个自然的问题是,是否会改变在MBD的变化是一个潜在的风险指标。换句话说,如果妇女的经验与玛嘉烈医院使用MBD的增加,是在更大的患乳腺癌的风险比女性谁减少或多动症,而维持他们在玛嘉烈医院?或者,如果一个女人对佐剂他莫昔芬降低多动症,这是否意味着她将有一个降低复发风险比女人谁没有在多动症,而使用tamoxifen的变化?
大多数研究表明,多动症的变化可能是一个战略的生物标志物进行化学预防癌症的妇女乳腺癌的风险减少了,可以让他莫昔芬治疗早期识别妇女谁不会受惠于 (28)。 研究还正在审查中MBD的变化与乳腺癌的风险该院使用的影响,结果将很快出台。在这个时候,目前尚不清楚是否造成的增加和减少与内分泌治疗多动症根本改变的能力,发现新的乳腺癌或涉及到的乳腺癌发病机制。需要更多的工作来改善我们的代理商,有助于改变多动症及其与乳腺癌的关系的认识。此外,多动症的再生和发展良好的校准测量密度的措施,可以准确地让需要治疗的类型比较全面的研究和多动症的变化 (28)。
摘要:
癌症风险评估是全面检讨和了解一个人的癌症风险的讨论。这包括获取信息方面因素,可能减轻癌症的风险(例如,使用激素疗法,口服避孕药,月经初潮年龄的使用和第一次生育)。风险评估的其他主要内容包括对癌症的遗传基础的讨论中,癌症家族病史,癌症,遗传综合征的可能性家族病史,以及检查和预防方案。基因检测是一个工具,可以完善的风险评估。基因测试之前执行,可能的结果和对个人和家庭的影响应该加以讨论。这昂贵的测试已经极小值的病人谁也不愿意让她亲戚的结果。如果基因测试是适当的,遗传咨询师或其他医护人员可协助调查保险基因检测,提供测试结果和后续服务,帮助病人告知风险的亲属。认识到内分泌治疗的反应变化是重要的,以便最有效的疗法,可对患者的管理,及时。这包括外源性雌激素的管理,以减少绝经后妇女健康的症状,以及乳房癌的妇女疾病的治疗。多动症可能有助于我们间的个体差异的认识,对治疗的反应。这些信息可以转化为临床个性化设置,以促进决策方面的乳癌治疗和减少风险的策略选择。
参考文献:
- Jemal A, Siegel R, Ward E, et al. Cancer statistics, 2009. CA Caner J Clin 2009;59:225-249
- Epidemiologic factors. In: Harris JR, Lippman ME, Morrow M, et al, eds. Diseases of the Breast. 3rd e. Philadelphia, PA: Lippincott Williams & Wilkins; 2004:260-264
- Ursin G, Ma H, Wu AH, et al. Mammographic density and breast cancer in three ethnic groups. Cancer Epidemiol Biomarkers Prev 2003;12:332-338
- Costantino JP, Gail MH, Pee D, et al. Validation studies for models projecting the risk of invasive and total breast cancer incidence. J Natl Cancer Inst 1999;91:1541-1548
- Gail MH, Brinton LA, Byar DP, et al. Projecting individualized probabilities of developing breast cancer for white females who are being examined annually. J Natl Cancer Inst 81(24):1879--86, 1989
- Humphrey LL, Helfand M, Chan BK, et al. Breast cancer screening: a summary of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2002;137:347-360. (Meta-analysis)
- Claus EB, Risch N, Thompson WD. Autosomal dominant inheritance of early-onset breast cancer: Implications for risk prediction. Cancer 1994;73:643-651
- Srivastava A, McKinnon W, Wood ME. Risk of breast and ovarian cancer in women with strong family histories. Oncology 2001;15:889-902
- Tyrer J, Duffy SW, Cuzick J. A breast cancer prediction model incorporating familial and personal risk factors. Stat Med 2004;23:1111-1130
- Amir E, Evans DG, Shenton A, et al. Evaluation of breast cancer risk assessment packages in the family history evaluation and screening program. J Med Genet 2003;40:807-814
- Pharoah PD, Antoniou A, Bobrow M, et al. Polygenic susceptibility to breast cancer and implications for prevention. Nat Genet 2002;31:33-36
- Antoniou A, Pharoah PD, Narod S, et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet 2003;72:1117-1130
- Chen S, Iversen ES, Friebel T, et al. Characterization of BRCA1 and BRCA2 mutations in a large United States sample. J Clin Oncol 2006;24:863-871
- American College of Obstetricians and Gynecologists; ACOG Committee on Practice Bulletins -- Gynecology; ACOG Committee on Genetics; Society of Gynecologic Oncologists. ACOG Practice Bulletin No. 103: Hereditary breast and ovarian cancer syndrome. Obstet Gynecol 2009;113:957-966
- Weitzel JN, Lagos VI, Cullinance CA, et al. Limited family structure and BRCA gene mutation status in single cases of breast cancer. JAMA 2007;297:2587-2595
- McCormack VA, dos Santos Silva I. Breast density and parenchymal patterns as markers of breast cancer risk: a meta-analysis. Cancer Epidemiol Biomarkers Prev 2006;15:1159-1169
- American College of Radiology. Breast Imaging Reporting and Data Systems BI-RADS. Reston, VA: American College of Radiology; 1998
- McTiernan A, Martin CF, Peck JD, et al. Estrogen-plus-progestin use and mammographic density in postmenopausal women: Women's Health Initiative randomized trial. J Natl Cancer Inst 2005;97:1366-1376
- Bremnes Y, Ursin G, Bjurstam N, et al. Different types of postmenopausal hormone therapy and mammographic density in Norwegian women. Int J Cancer 2007;120:880-884
- Greendale GA, Reboussin BA, Slone s, et al. Postmenopausal hormone therapy and change in mammographic density. J Natl Cancer Inst 2003;95:30-37
- US Preventive Services Task Force. Postmenopausal hormone replacement therapy for primary prevention of chronic conditions: recommendations and rationale. Ann Intern Med 2002;137:834-839
- Buist DS, Anderson ML, Reed SD, et al. Short-term hormone therapy suspension and mammography recall: a randomized trial. Ann Intern Med 2009;150:752-765
- Vogel VG, Costantino JP, Wicherham DL, et al. National Surgical Adjuvant Breast and Bowel Project (NSABP). Effects of tamoxifen vs raloxifene on the risk of developing invasive breast cancer and other disease outcomes: the NSABP Study of Tamoxifen and Raloxifene (STAR) p-2 trial. JAMA 2006;295:2727-2741
- Brisson J, Brisson B, Cote G, et al. Tamoxifen and mammographic breast densities. Cancer Epidemiol Biomarker Prev 2000;9:911-915
- Eilertsen AL, Karssemeijer N, Skaane P, et al. Differential impact of conventional and low-dose oral hormone therapy, tibolone and raloxifene on mammographic breast density, assessed by an automated quantitative method. BJOG 2008;115:773-779
- Vachon CM, Ingle IN, Suman VJ, et al. Pilot study of the impact of letrozole vs. placebo on breast density in women completing 5 years of tamoxifen. Breast 2007:16:204-210
- Vachon CM, van Gills CH, Sellers TA, et al. Mammographic density, breast cancer risk and risk prediction. Breast Cancer Res 2007;9:217
- Lee CH, Dershaw DD, Kopans D, et al. Breast Cancer Screening with Imaging: Recommendations From the Society of Breast Imaging and the ACR on the Use of Mammography, Breast MRI, Breast Ultrasound, and Other Technologies for the Detection of Clinically Occult Breast Cancer. J Am Coll Radiol 2010;7:18-27
发布时间: 10 May 2010
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


