وراثي تقييم المخاطر السرطان في أمراض النساء
[وهك] ممارسة نشرة وسريرية إدارة لمقدمي الرعاية الصحية. قدمت منحة للتربية وصحة المرأة وتربية مركز ([وهك]).
يجب أن تكون وراثية تقييم خطر الاصابة بسرطان جزءا من روتين التوليد وأمراض النساء الممارسة. على مدى العقد الماضي كان هناك زيادة في الوعي الاستعداد الوراثي لمجموعة واسعة من الأمراض بما في ذلك السرطان وأمراض القلب، والسكري. هذه كلها اضطرابات متعددة الجينات معقدة، ولكن سمح تحديد جينات معينة ترتبط مع الاستعداد لهذه الشروط الأطباء إلى تقييم أدق للمخاطر ويصف التدخلات الوقائية. على الرغم من أنه قد يكون غير مألوف لكثير من الممارسين، يمكن للعملية التقسيم الطبقي خطر الاصابة بسرطان يكون كفاءة وفعالية. باستخدام تقييم يحركها بروتوكول الوقاية من الاصابة بالسرطان، وعوامل الخطر الشخصية والعائلية، والاختبارات الجينية، فمن الممكن لإنشاء ملفات تعريف المخاطر واستراتيجيات الإدارة التي تثبت الحد ثبت في المراضة والوفيات السرطانية. قبل عقود الاختبارات الجينية دخلت الممارسة، وكان الأطباء عبئا لا مبرر له من سرطان الثدي والمبيض، وغالبا ما تتميز حالات الإصابة المبكرة وسرطان الثدي لدى الرجال. في منتصف 1990s-تحليل الربط في هذه الثدي والمبيض تمكين الأسر سرطان تحديد BRCA1 و BRCA2 ، الجينات التي تعمل عادة في إصلاح الحمض النووي. المستشارين الوراثية سرطان استخدام تحليل النسب والمؤشرات السريرية لتقييم احتمال أن المريض يحمل طفرة وراثية، لتحديد استراتيجيات الاختبار المعتمد بين مجموعة متزايدة التعقيد من فحوصات متوفرة تجاريا، وتفسير النتائج وتوجيه التوصيات الطبية. اكتشاف علمي، وتوعية الجمهور على نطاق واسع، ومدى توافر العامة من الاختبارات الجينية السريرية لل BRCA1 و BRCA2 الجينات المسؤولة عن غالبية العائلية الثدي وسرطان المبيض، وأدت النساء أن تقدم إلى مكاتب الطبيب الطالبة الاختبارات الجينية والتشكيك في الآثار السريرية بالنسبة لهم، و أسرهم.
والغرض من هذه الوثيقة لاستعراض التوصيات الحالية للاختبار وراثي للحساسية لأنواع السرطان، بما في ذلك المبيض، قناة فالوب، وسرطان الثدي، بطانة الرحم، وسرطان القولون بسبب الطفرات الموروثة في BRCA الجينات أو في الجينات المرتبطة إصلاح عدم تطابق وراثي نونبوليبوسيس سرطان القولون (HNPCC) متلازمة. يبقى التاريخ الأسرة حجر الزاوية في تحديد المريض. يتم تقييم روتيني العرق والعرق كجزء من التقييم. تطبيقات عملية الاختبارات الجينية للسرطان القابلية لديها القدرة على الحد من عبء السرطان وراثية من قبل إنقاذ الأرواح، وخفض حالة مرضية طبية، والحد من الإجهاد النفسي. وتعالج أيضا إدارة حاملات التحور، بما في ذلك مؤشرات للتقليل مخاطر العمليات الجراحية، وفحص سرطان، ومتابعة،. ويركز الاستعراض أيضا على الممارسات السريرية والاستخدام العملي للسرطان علم الوراثة السريرية.
خلفية
وهناك العديد من المتلازمات التي تمنح ورثت خطر سرطان الثدي، المبيض، وسرطان ذات صلة مع 5٪ إلى 15٪ من جميع الثدي وسرطان المبيض الناجم عن واحدة من هذه جسمية، متلازمات السرطان ورثت مهيمن (2),(1) . وتنتقل جميع الجينات المرتبطة متلازمات وراثية سرطان بطريقة جسمية مسيطرة المندلية، الاسرة وتاريخها حتى الأمهات والأب أيضا أن تساهم في خطر المريض وتحتاج إلى تقييم لتحديد مدى ملاءمة اختبار. وتجدر الإشارة، مع ذلك، أنه على الرغم من ورثت طفرات الجينات بطريقة جسمية مسيطرة، يتم التعبير عنها بطريقة المتنحية (2) . الفرد الذي يرث طفرة سلالة الجرثومية أن يعطل نسخة واحدة من الجين بشكل عام لديه نسخة سليمة وظيفيا الثانية من الجين. هو فقط عندما هذه النسخة العادية المتبقية يصبح تحور أن الخلية قد يخضع لعملية التحول الخبيث.
دور أطباء النساء والتوليد يشمل:
- الاعتراف أنماط الأمراض العائلية الموروثة توحي قابلية لمرض السرطان، بما في ذلك أعراض مألوفة وشائعة من وراثي الثدي وسرطان المبيض (HBOC) وراثية نونبوليبوسيس سرطان القولون والمستقيم (HNPCC أو متلازمة لينش)؛
- دمج تقييم المخاطر، والاختبارات الجينية، وتفسير النتائج في الممارسة اليومية؛
- توجيه الإدارة الطبية على أساس التقسيم الطبقي للخطر.
المخاطر متقطعة، المخاطر العائلية، والمخاطر وراثي
أكثر من 10٪ من المرضى الذين لديهم تاريخ شخصي أو عائلي الصحة يوحي وراثي أو عائلي الوقاية من الاصابة بالسرطان، وأكثر من 6٪ من المرضى تلبية شبكة (NCCN) معايير الشامل للسرطان الوطني للالاختبارات الجينية (3). ثلاثة ملامح المخاطر ظهرت:
- خطر متفرقة ، الذي يعرف بأنه متوسط عدد السكان أو المريض منخفضة المخاطر؛
- خطر العائلي ، الذي يعرف كأسرة واحدة وجود العديد من الأقارب مع نوع معين أو خبيثة؛
- خطر وراثي ، الذي يعرف بأنه وجود سرطان واحد أو متلازمة من الأورام الخبيثة في الأسرة، والتي ترتبط مع الطفرات الضارة المعروفة وراثية في جينات معينة (أي، BRCA ).
خطر وراثي يحمل أعلى نسبة من قابلية الإصابة بسرطان، بينما خطر متفرقة يحمل أدنى. مع التقسيم الطبقي للخطر، يمكننا تحديد الأفراد الذين قد يستفيدون من فحص مكثفة، الاختبارات الجينية، والتدخلات مثل الوقاية الكيماوية والحد من مخاطر الجراحة. الاختبارات الجينية للأفراد مناسبة تمكن مزيد لنا لتحديد المرضى الذين يعانون من متلازمات وراثية سرطان، لمصلحتهم الخاصة وكذلك أن الأسرة بأكملها. مرة واحدة يتم تحديد تاريخ عائلي من مرض السرطان، وتستخدم النماذج التي تناقش أدناه للتنبؤ بسرطان معين، واحتمال وجود طفرة جينية، هو الذي يجعل المريض إلى متلازمة سرطان وراثي. الموافقة المستنيرة، بما في ذلك المخاطر والمنافع، والخيارات، والتوقعات، ينبغي أن تناقش بشكل كاف. تقديم المشورة المباشرة من الضروري في حالة وجود أسرة غير طبيعية أو التاريخ سرطان الشخصية. الإرشاد غير المباشر يقلل فرصة المريض لزيادة المراقبة والتشخيص المحتملة في وقت مبكر والوقاية من السرطان، ويضع الطبيب في خطر لالمسؤولية في المستقبل.
الثدي وراثي وسرطان المبيض (HBOC) متلازمة
وراثي الثدي وسرطان المبيض متلازمة (HBOC) هو متلازمة سرطان القابلية الموروثة. السمات المميزة لهذه المتلازمة هم من أفراد الأسرة متعددة مع سرطان الثدي أو سرطان المبيض أو كليهما، وحضور كل من سرطان الثدي وسرطان المبيض في فرد واحد وسن مبكرة من بداية سرطان الثدي. في منتصف 1990s وقد تبين أن ورثت طفرات في جينات BRCA1 و BRCA2 الجينات، على الكروموسومات 17 و 13 على التوالي، وكانت مسؤولة عن معظم العائلية الثدي وسرطان المبيض. كل من النساء والرجال قد تحمل متحولة BRCA الجين ونقله لأبنائهم.
تحذيرات علامات لمتلازمة HBOC - قصص شخصية والتاريخ العائلي جيل ثلاثة (4):
- سرطان الثدي إذا كنت تحت سن أو premenopause 50 عاما، ثنائية، ثلاثية السلبية، أو ذكر؛
- إذا كان لديك سرطان المبيض، أي عمر، عادة الظهارية، الصف مصلية عالية؛
- إذا كان لديك سرطان البنكرياس، سرطان الجلد، أو سرطان البروستاتا وهم تحت سن 50 عاما؛
- نزعة العرقية: اشكنازي اليهود وغيرهم (على سبيل المثال، مكسيكية، الايسلندي والهولندية والمجرية)؛
- طفرة BRCA المعروفة في الأسرة.
BRCA1 و BRCA2
ما يقرب من 10٪ من حالات سرطان المبيض و3-5٪ من حالات سرطان الثدي بسبب الطفرات الجرثومية في BRCA1 و BRCA2 (1),(5) . BRCA1 تم العثور على كروموسوم 17، و BRCA2 على كروموسوم 13. وقد تم الإبلاغ عن أكثر من 1،200 طفرات مختلفة ل BRCA1 ، وتم الإبلاغ عن أكثر من 1،300 طفرات مختلفة ل BRCA2 . BRCA1 و BRCA2 هي الجينات الكابتة للورم أن ترميز البروتينات التي تعمل في عملية إصلاح الحمض النووي (6) . على الرغم من أن الأفراد الذين يعانون من متلازمة HBOC ترث واحد أليل عيب في BRCA1 و BRCA2 من الأب أو الأم، لديهم الثانية، أليل وظيفية. إذا أصبح أليل الثاني غير وظيفية، ويمكن تطوير سرطان من خلال تراكم الطفرات إضافية. وهذا ما يسمى "فرضية ضرب اثنين" (7) . في عامة السكان، وتشير التقديرات إلى أن ما يقرب من 1 في 300-1 في 800 الأفراد تحمل طفرة في جينات BRCA1 و BRCA2 (8) . يمثل السكان اليهود الأشكناز استثناء ملحوظا لأن هناك ثلاثة الطفرات مؤسس محددة ( BRCA1 كودون 185deletion AG، BRCA1 كودون 5374 إدراج C، و BRCA2 كودون 6174 حذف T) التي يحملها حوالي 2.5٪ من الأفراد (8) . في ضوء ذلك، فإن معظم الخبراء لديهم عتبة أقل بكثير عن الاختبارات الجينية في النساء اليهوديات.
للمرأة، مع BRCA1 تحور، من خطر الاصابة بسرطان المبيض هو 39-46٪. للمرأة مع BRCA2 الطفرة، من خطر الاصابة بسرطان المبيض هو 12-20٪. فإن خطر المقدرة من سرطان الثدي مع BRCA1 أو BRCA2 الطفرة هو 65-70٪ (9) . وبالنسبة للنساء المصابات بسرطان الثدي، والمخاطر الاكتوارية 10 سنوات من الإصابة بسرطان المبيض لاحقة هو 12.7٪ لل BRCA1 حاملات التحور و 6.8٪ لل BRCA2 حاملات التحور (10) . سرطان المبيض يرتبط مع BRCA1 و BRCA2 الطفرات لديه النمط الظاهري نسيجية متميزة. هذا النوع من السرطان هو في الغالب من الأنسجة المصلية أو شبيهة ببطانة الرحم والدرجة العالية. لا تظهر موسيني والشريط الحدودي سرطان المبيض لتكون جزءا من الطيف الورم (11) . الابتدائي سرطان قناة فالوب وسرطان البريتوني الابتدائي هي أيضا من الطيف من الأمراض المرتبطة BRCA1 و BRCA2 الطفرات (12).
معايير لتقييم المخاطر الوراثية
المرضى الذين يعانون من أكثر من فرصة 20-25٪ تقريبا من وجود راثية لسرطان الثدي وسرطان المبيض ولمن ينصح تقييم المخاطر الجينية (13):
- النساء مع التاريخ الشخصي لكل من سرطان الثدي وسرطان المبيض *
- النساء المصابات بسرطان المبيض * وقريب † المصابات بسرطان المبيض أو سرطان الثدي قبل انقطاع الطمث أو كليهما؛
- النساء المصابات بسرطان المبيض * الذين هم من أصل يهودي أشكنازي؛
- النساء المصابات بسرطان الثدي في سن 50 عاما أو أصغر سنا وقريب † المصابات بسرطان المبيض أو سرطان الثدي * الذكور في أي عمر؛
- تم تشخيص النساء من أصل اشكنازي اليهودية في سرطان الثدي الذين في سن 40 سنة أو أقل؛
- المرأة مع قريب † مع المعروف BRCA1 أو BRCA2 الطفرات.
وينبغي النظر * سرطان الغشاء البريتوني أنابيب فالوب وجزء من الطيف من متلازمة HBOC.
يتم تعريف † إغلاق النسبي هو احد اقارب من الدرجة الأولى (الأم، الأخت، الابنة) أو قريب من الدرجة الثانية (الجدة، حفيدة، وعمة، وابنة).
المرضى الذين يعانون من أكبر من مجرد فرصة 5-10٪ تقريبي من وجود راثية لسرطان الثدي وسرطان المبيض ولمن تقييم المخاطر الجينية قد تكون مفيدة (13) :
- النساء المصابات بسرطان الثدي في سن 40 سنة أو أقل؛
- النساء المصابات بسرطان المبيض وسرطان البريتوني الابتدائي، أو سرطان قناة فالوب من الدرجة العالية، وعلم الأنسجة المصلية في أي سن؛
- النساء المصابات بسرطان الثدي الثنائية (وخاصة إذا تم تشخيص أول حالة سرطان الثدي في سن 50 سنة أو أقل)؛
- النساء المصابات بسرطان الثدي في سن 50 عاما أو أصغر سنا وقريب مع سرطان الثدي في سن 50 سنة أو أقل؛
- نساء من أصل يهودي أشكنازي المصابات بسرطان الثدي في سن 50 سنة أو أقل؛
- النساء المصابات بسرطان الثدي في أي عمر واثنين أو أكثر من أقارب المصابات بسرطان الثدي في أي عمر (وخاصة إذا تم تشخيص حالة واحدة على الأقل من سرطان الثدي في سن 50 سنة أو أقل)؛
- المرأة تتأثر مع قريب أن يلتقي أحد المعايير السابقة.
أداة يحرز خطر لمتلازمة HBOC
وضعنا أداة تعليمية رقمية بسيطة والتي يمكن استخدامها لتقدير ترشيح المريض ل BRCA اختبار. هذه الأداة يقارب المبادئ التوجيهية NCCN بواسطة تعيين 1 أو 2 نقطة ليصل الى كل شخص مع كل "العلم الأحمر" سرطان ذات الصلة في شجرة العائلة ثلاثة أجيال. تضاف النقاط المريض جنبا إلى جنب مع نقاط الأمهات وثم مرة أخرى مع نقاط الأب. ومن شأن مجموع 0 نقطة تشير إلى وجود تصنيف متفرقة (منخفض). ومن شأن مجموع 1 نقطة تشير عادة الأسرية (وسط) تصنيف المخاطر، ومع ذلك، قد يكون المريض 1 نقطة لا تزال مؤهلة للحصول على الاختبارات الجينية إذا كان هناك هيكل الأسرة محدودة أو نزعة عرقية إلى BRCA الطفرات. سوف مبلغا من> 2 نقطة التأهل عموما ل BRCA الاختبار، على الرغم من أن المجموعات التي تنطوي على الأقارب من الدرجة الثالثة يمكن تقييم لتحديد ما إذا كان هناك ما يبرر الاختبار. يجب فقط أن تستخدم هذه الأداة بشكل تقديري، وليس دليلا قاطعا الاختبار.
دائرة كل بند من أن يشير لك. ثم مجموع المبلغ كما أ + ب، أ + ج
- أي نقطة 1 = ديهم خطر عائلي، للخطر وراثية محتملة اذا الأسرة الصغيرة (LFS)
- أي نقطتين = BRCA مرشح اختبار
كل السرطان الأولية النظر بشكل منفصل
عائلتك = 1st و 2nd و 3rd أقارب الدرجة في بعض الأحيان درجة نسبية.
إضافة الأم والأب النتائج بشكل منفصل للمريض
| Patient (a) | Maternal (b) | Paternal (c) | |
| Breast, <50 years (premenopause) | 2 | 1 | 1 |
| Breast, <60 years, triple negative | 2 | 1 | 1 |
| Breast, >50 years, not triple negative | 1 | 1 | 1 |
| Breast, bilateral, any age | 2 | 2 | 2 |
| Breast, male, any age | 2 | 2 | 2 |
| Ovary, epithelial, any age | 2 | 2 | 2 |
| Pancreas | 1 | 1 | 1 |
| Known mutation carrier | - | 2 | 2 |
| Ashkenazi Jewish (or other high-risk group) |
1 | 0 | 0 |
| Total: a+b = ---------- points; a+c = ---------- points | |||
HBOC, hereditary breast and ovarian cancer; LFS, Li-Fraumeni syndrome
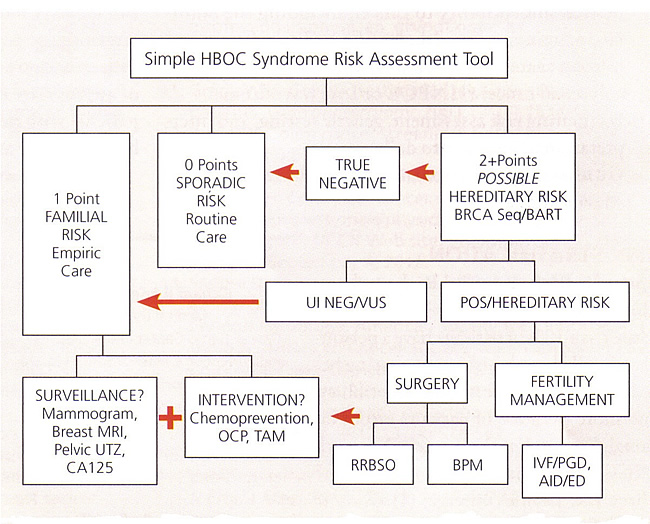
Abbreviations: AID, artificial insemination by donor; BART, BRCA Analysis rearrangement test; BPM, bilateral prophylactic mastectomy; CA 125, cancer antigen 125; ED, egg donation; HBOC, hereditary breast and ovarian cancer; IVF, in-vitro fertilization; MRI, magnetic resonance imaging; OCP, oral contraceptive pills; PGD, preimplantation genetic diagnosis; POS, positive; RRBSO, risk-reducing bilateral salpingo-oophorectomy; TAM, tamoxifen; UI NEG, uninformative negative; UTZ, ultrasound; VUS, variant of uncertain significance.
الاستشارة الوراثية للحد من خطر الاصابة بسرطان الثدي
وينبغي أن تشمل الاستشارة الوراثية مناقشة النتائج المحتملة للاختبار - تتناول على وجه التحديد قضايا من نتائج الاختبار إيجابية أو سلبية، ومبهمة، أو متغيرات ذات أهمية غير معروف. وينبغي مناقشة خيارات للمراقبة والوقاية الكيماوية، وجراحة تقليل المخاطر قبل إجراء الاختبار. كما ينبغي النظر في الآثار المترتبة نفسي وعائلي ممكن من نتائج الاختبار. المواد المكتوبة قد يساعد الأفراد تبادل المعلومات مع الأقارب حول المخاطر الجينية إمكاناتهم. وينبغي أن تشمل الدورة الاستشارة الوراثية أيضا مناقشة من تكلفة الاختبارات الجينية. فإن العديد من شركات التأمين، بما في ذلك الرعاية الصحية، وتغطي جزءا كبيرا من حساب لبعض الأفراد. الرعاية الصحية وشركات التأمين الأخرى قد كتبت مبادئ توجيهية لتغطية تكاليف الاختبارات الجينية. جانبا هاما من الاستشارة الوراثية هو مناقشة التشريعات الحالية المتعلقة بالتمييز الجيني وخصوصية المعلومات الجينية. قانون عدم التمييز المعلومات الوراثية الاتحادية 2008 يحمي الأفراد من الصحة والتمييز في التوظيف على أساس المعلومات الجينية. لديك العديد من الدول أيضا قوانين الدولة التي توفر حماية مماثلة. لا تنطبق هذه القوانين على أشكال أخرى من التأمين، والتي قد تشمل الحياة أو التأمين ضد العجز.
من الناحية المثالية، فمن المنطقي أن تبادر بإجراء اختبار في الفرد المتضررة. إذا، ومع ذلك، لا الفرد المصاب هو متاح، قد الاختبارات الجينية لا تزال توفر معلومات مفيدة. إذا تم التعرف على الطفرات الضارة، المرضى المعرضين للخطر ويمكن نصح بشكل ملائم حول الفحص أو نهج الحد من المخاطر الأخرى. إذا تم تحديد أي طفرة ضارة، وتحتاج إلى المرضى يكون ناصحا أن هذا يمكن أن يكون بسبب واحد من عدة احتمالات منها: (أ) طفرة ضارة موجودة في الأسرة أن المريض لم يرث؛ (ب) طفرة لا يمكن الكشف عنها في BRCA1 و BRCA2 ، أو لم تحدد هويتهم بعد سرطان الجينات قابلية موجود في الأسرة، وأنه لا يزال غير معروف ما إذا كان المريض حصة هذا الاستعداد، أو (ج) لا راثية في العائلة.
الاستراتيجيات الحالية للحد من خطر الاصابة بسرطان المبيض أو سرطان قناة فالوب في النساء المعرضات للخطر عالية مع الضارة المعروفة BRCA الطفرات وتشمل المراقبة، والوقاية الكيماوية، والجراحة. ونظرا لمخاطر عالية للغاية للكشف عن سرطان المبيض وسرطان قناة فالوب في النساء مع الطفرات في جينات BRCA1 و BRCA2 ، وقد أوصى الجماعات إجماع فحص الدوري مع CA 125 والموجات فوق الصوتية عبر المهبل، ابتداء تتراوح أعمارهم بين 30 سنوات و 35 سنة أو 5-10 سنوات سابقة من سن مبكرة من التشخيص الأولى من سرطان المبيض في الأسرة (14) . قلة انتشار سرطان المبيض واحتمال ارتفاع إيجابية الفحص نتيجة الفحص يستلزم مزيدا من التقييم الجراحية الغازية هي العقبات في برامج فحص سرطان المبيض لدى النساء في خطر الموروثة (15) . ومن المؤمل أن المستقبل محاكمة سرطان المبيض سوف تستفيد من أفضل علامات المصل وتحسين خوارزميات الفرز لتعزيز القدرة على التمييز بين CA العادية وغير العادية 125 القيم ونتائج الموجات فوق الصوتية. فوائد وحجم انخفاض خطر مع حبوب منع الحمل للنساء مع BRCA لم يتم الإبلاغ عن طفرة وباستمرار أما بالنسبة للعامة، والسكان منخفضة المخاطر. فمن المعقول بالنسبة للمرأة مع طفرات في جينات BRCA1 و BRCA2 ، لاستخدام وسائل منع الحمل عن طريق الفم. وتفيد معظم الدراسات وجود انخفاض خطر الإصابة بسرطان المبيض بين أولئك الذين استخدموا وسائل منع الحمل عن طريق الفم لمدة أطول (أكثر من 3 إلى 6 سنوات) (16) . المخاطر والمزايا النسبية لكلا الوقاية الكيماوية والسيطرة الإنجابية يجب أن يكون وزنه بعناية من قبل المريض والطبيب لها.
الثنائية الوقائي Salpingo-oophorectomy (BSO)
فمن المستحسن في النساء الذين يحملون BRCA الطفرات بسبب ارتفاع معدل الوفيات من سرطان المبيض وعدم وجود غربلة فعالة ونهج الوقاية (17) . لحسن الحظ، فإن خطر وراثي الثدي وسرطان المبيض لا ترتفع بشكل كبير حتى 30S في وقت متأخر من النساء مع BRCA1 الطفرات، وأواخر 50s للنساء مع BRCA2 الطفرات (18) ، لذلك يكون للمرأة فرصة لإكمال أسرهم قبل ان يخضع BSO. ينبغي إلى حد كبير يتم التخلي عن الممارسات السابقة من أداء عملية جراحية وقائية تستند فقط على التاريخ العائلي. نصف النساء في الأسر مع BRCA لن يكون من المتوقع أن تكون حاملة الطفرات. حاليا، ويستند القرار إلى المضي قدما في عملية جراحية وقائية BSO في المقام الأول على نتائج BRCA تحليل طفرية. هناك بعض الأدلة على أن أنواع معينة من BRCA الطفرات قد يؤهب بقوة أكبر لسرطان المبيض، ولكن لم يتم تأكيد هذه الملاحظة على الدوام (19) . على الرغم من BSO هو إجراء العمليات الجراحية الكبرى، تشير الدراسات إلى أن معظم النساء ذات المخاطر العالية تمر الاختبارات الجينية قبول قائية الثنائية البوق و المبيض. تنظير البطن والبطن على حد سواء خيارات للحد من مخاطر BSO. لكل من الإجراءات، تفتيش دقيق من السطوح البريتوني هو ضروري. وينبغي الحصول على الغسيل البريتوني. يتم تفتيشها الحجاب الحاجز والكبد والثرب والأمعاء، المزاريب المجاورة للقولون، والتذييل في البطن. يتم فحص المبيضين وقناتي فالوب والرحم والمثانة المصلية، وطريق غير كيس دي في الحوض. وينبغي لأي مناطق غير طبيعية الخضوع لخزعة. الأوعية المبيض يجب أن تكون معزولة و ligated الأقرب إلى نهاية أنسجة المبيض يمكن تحديدها لضمان أن جميع أنسجة المبيض تتم إزالة تماما. إذا لم يتم إجراء عملية استئصال الرحم، ينبغي تقسيم قناة فالوب في إدخاله داخل قرن الرحم. عند تنفيذ إجراء بالمنظار، لتحسين المحافظة على ظهارة سطح المبيض، والعينات ويمكن وضعها في كيس بالمنظار قبل إزالة من البطن. قرار إجراء عملية استئصال الرحم المتزامنة يجب أن تكون فردية. تشمل الحجج المؤيدة لاستئصال الرحم استراتيجية العلاج بالهرمونات أكثر مبسطة (مع هرمون الاستروجين فقط) وزيادة خطر نظري من سرطان في قناة فالوب القرنية (20) . وبالإضافة إلى ذلك، يمكن اعتبار استئصال الرحم عندما تكون هناك دلائل طبية أخرى لإزالة الرحم وعنق الرحم. وبالنسبة للنساء مع عقار تاموكسيفين، يمكن اعتبار استئصال الرحم للحد من خطر الاصابة بسرطان بطانة الرحم (21) .
إيجابيات وسلبيات من الحد من المخاطر Salpingo oophorectomy
الايجابيات:
- يقلل المبيض وقناة فالوب الإصابة بسرطان أنبوب والوفيات؛
- وغالبا ما يتأخر للسماح الانتهاء من الإنجاب؛
- نهج بالمنظار ممكن في معظم الحالات؛
- تأثير على صورة الجسم مقبول عموما؛
- يمكن استبدال هرمون الاستروجين منع عواقب انقطاع الطمث الجراحي؛
- يقلل خطر الاصابة بسرطان الثدي.
سلبيات:
- التكلفة؛
- المراضة والوفيات المحتملة؛
- المحتملة صغيرة ولكنها المتبقية لاحقة سرطان البريتوني الابتدائي؛
- انقطاع الطمث الجراحي في المرضى قبل انقطاع الطمث الذين يختارون عدم اتخاذ بالهرمونات البديلة.
ما العمر إلى النظر في الحد من المخاطر Salpingo-oophorectomy?
تخفيض المخاطر والاختيارية البوق و oophorectomies هي إزالة المبيضين وقناتي فالوب عن الفوائد المحتملة للوقاية من المراضة والوفيات على المدى الطويل. مصطلح الحد من المخاطر البوق و المبيض يعني أن المبايض طبيعية في وقت الإزالة. النساء مع BRCA1 أو BRCA2 الطفرات وينبغي أن تقدم في الحد من المخاطر البوق و المبيض قبل سن 40 سنة، أو عند اكتمال الحمل (13) . وسيتم تشخيص سرطان المبيض في أقل من 2-3٪ من النساء مع BRCA1 أو BRCA2 الطفرات قبل سن 40 عاما. وبالنسبة للنساء مع BRCA1 الطفرات، من خطر الاصابة بسرطان المبيض يزيد بشكل ملحوظ خلال 40S، مع 10-21٪ من BRCA1 حاملات التحور بسرطان المبيض قبل سن 50 عاما. من خطر الاصابة بسرطان المبيض قبل انقطاع الطمث هو أقل من ذلك بكثير في BRCA2 حاملات التحور، مع عدم وجود أكثر من 3٪ من BRCA2 حاملات التحور بسرطان المبيض قبل سن 50 سنة (22),(13) . نظرا لتوقيت مختلفة من خطر الاصابة بسرطان المبيض، ويمكن إجراء الاعتبار لتقديم المشورة المرضى الذين يعانون من BRCA1 الطفرات بشكل مختلف عن ل BRCA2 حاملات التحور. ومع ذلك، والمرأة مع BRCA2 الطفرات لديهم فرصة 26-34٪ للإصابة بسرطان الثدي قبل سن 50 سنة (22),(18) ، والاستفادة القصوى من إزالة المبايض للحد من خطر الاصابة بسرطان الثدي ويتحقق في وقت سابق تتم إزالة المبيضين (23) . ونظرا لهذه القضايا، توقيت في الحد من المخاطر وينبغي أن تستند البوق و المبيض على احتياجات المريض الفردية، مع الأخذ بعين الاعتبار رغبتهم في الحفاظ على الخصوبة أو منع سابق لأوانه انقطاع الطمث الجراحي مع الأثر التي تعتمد على العمر من خطر الحد من التهاب البوق و المبيض على حد سواء الثدي السرطان ومخاطر الإصابة بالسرطان الجهاز التناسلي للمرأة.
استئصال البوق والمبيض الوقائية تأخر
وينصح قائية الثنائية البوق و المبيض للنساء مع BRCA الطفرات، ولكن هناك عواقب السلبية لانقطاع الطمث السابق لأوانه. غالبية BRCA تظهر سرطان المبيض المصاحب لتنشأ في قناة فالوب، وبالتالي، قد يكون بديلا لاستئصال البوق الثنائية البوق و المبيض. على أن يكون مفهوما أنه ربما 60٪ من السرطانات المصلية الحوض قد تنشأ في قناة فالوب، وكان هناك نقاش في الآونة الأخيرة من خطر الحد من استئصال البوق كبديل محتمل لمخاطر الحد من BSO لعلاج BRCA حاملات التحور، وخاصة في النساء يترددون على الخضوع لخطر الحد من BSO (39) . الكتاب نشر على ماركوف مونتي كارلو المحاكاة مقارنة BSO الحد من المخاطر في 40 سنة من العمر مع كل من استئصال البوق الحد من المخاطر في 40 سنة من العمر تليها المبيض الثنائية تأخر في 50 سنة من العمر (40) . هذا النموذج مدروس تتوقع الانخفاض المتوقع في السرطانات المصلية الحوض، سرطان الثدي، وحالة وفاة إضافية بسبب مرض القلب والأوعية الدموية. الاستنتاج كانت الدراسة الثنائية البوق و المبيض غالبا ما يكون أكبر انخفاض خطر الإصابة بسرطان الثدي والمبيض بين BRCA حاملات التحور. ومع ذلك، عند النظر في نوعية المعدلة حسب متوسط العمر المتوقع، استئصال البوق الثنائية مع تأخر المبيض هو استراتيجية فعالة من حيث التكلفة ويمكن أن تكون بديلا مقبولا للذين لا يرغبون في الخضوع الثنائية البوق و المبيض (40) . ومن المهم التأكيد على أن مستوى الرعاية للنساء وراثة الطفرات الجرثومية في BRCA1 و BRCA2 لا يزال BSO قائية بعد الانتهاء من الحمل أو حول سن 40 عاما. ويقدم أكبر تخفيض خطر الاصابة بسرطان الثدي والمبيض مقارنة مع استئصال البوق مع أو بدون تأخر المبيض. ومع ذلك، فإن نسبة كبيرة من النساء لا تخضع BSO، واختيار العديد من المراقبة وحدها للكشف عن سرطان المبيض على الرغم من فائدة محدودة من طرق الفحص الحالية (41) . يدفع سرطان المبيض معدل وفيات BRCA حاملات التحور، وبالتالي فإن أي تدخل أن يقلل من خطر الاصابة بسرطان المبيض من المرجح أن يتم التحقق من صحة مستقبلي، استئصال البوق الثنائية مع تأخر المبيض قد تكون بديلا معقولا لBSO، خصوصا بالنسبة لأولئك الذين لا يرغبون في الخضوع لهذا الأخير الإجراء بسبب التأثير المحتمل على نوعية الحياة.
إدارة المرأة مع قوي التاريخ الأسري وسلبي BRCA1 أو BRCA2 الطفرة
على الرغم من أنه في معظم الحالات، هو سبب وراثية لسرطان المبيض عن طريق الطفرات في جينات BRCA1 أو BRCA2 ، لا تسمح التكنولوجيا الحالية تحديد جميع الطفرات التي يجب أن تكون موجودة في هذه الجينات (24) . بالإضافة إلى ذلك، قد اقترح دراسات الربط التي هي أقل من نصف الأسر التي لديها أربعة أو أكثر من حالات سرطان الثدي، ولكن لم يتسبب في حالات سرطان المبيض (أسر مع سرطان الثدي مواقع محددة)، وسرطان الثدي بنسبة BRCA1 أو BRCA2 الطفرة (25) . ونظرا لهذه القضايا، والنساء الذين لديهم تاريخ شخصي أو عائلي للإصابة بسرطان الثدي الذين اختبار السلبية ل BRCA ينبغي أن تدار طفرة بناء على تاريخ عائلاتهم. وأشارت بيانات أولية أن النساء من الأسر التي لديها تاريخ في الإصابة بسرطان الثدي في مواقع محددة في الذي لا BRCA تظل يتم التعرف طفرة في زيادة كبيرة في مخاطر الاصابة بسرطان الثدي، ولكن قد لا تكون في خطر متزايد من سرطان المبيض (26) . من المهم بالنسبة للأفراد ذات المخاطر العالية على البقاء على اتصال مع الأطباء من ذوي الخبرة في مجال رعاية النساء في خطر متزايد، نظرا النامية بسرعة البحوث والتحسينات في مجال التكنولوجيا الاختبار. على سبيل المثال، اختبارا لإعادة ترتيب كبيرة في BRCA1 و BRCA2 قد تم تطوير الجينات التي قد تساعد على تحديد الطفرات في نسبة مئوية صغيرة من العائلات ذات الخطورة العالية الذين سبق اختبارها السلبية لهذه الجينات.
خيارات الإنجابية
ويمكن لنتائج الاختبارات الجينية لها تأثير عميق على قرارات تنظيم الأسرة بالنسبة للأفراد في سن الإنجاب الذين وجدت لتكون حاملة لل BRCA1 / 2 الطفرات. على سبيل المثال، في الحالات التي تحمل كلا الشريكين و BRCA2 الطفرة، قد يكون هناك مخاطر عالية للذرية لتطوير النادرة فانكوني فقر الدم / الدماغ النمط الظاهري الورم (اضطراب المتنحية). المشورة للخيارات الإنجابية مثل التشخيص قبل الولادة، سابق للانغراس التشخيص الوراثي (PGD) والمساعدة على الإنجاب بالتالي قد يكون له ما يبرره للأزواج أعرب عن قلقه إزاء BRCA طفرة حالة الناقل من ذريتهم في المستقبل. وينبغي أن تشمل هذه المشورة مناقشة شاملة للمخاطر المحتملة، والفوائد، والقيود المفروضة على الخيارات الإنجابية. ويشمل التشخيص قبل الولادة التحليل الجيني في مرحلة ما بعد زرع الجنين في وقت مبكر، وذلك باستخدام الزوائد المشيمية أو الأمنيوسي عينات الخلايا السوائل؛ تجرى فيها الاختبارات الجينية عادة بين الأسبوع 12 والأسبوع 16 من الحمل، ونتائج اختبار يمكن أن تؤدي إلى قرار الزوجين لإنهاء الحمل (27) .
خلال العقدين الماضيين، برزت PGD كطريقة بديلة من الاختبارات الجينية في الأجنة في وقت مبكر. PGD ينطوي على اختبار 1 أو 2 الخلايا من الأجنة في المراحل المبكرة جدا من التنمية (أي 6 إلى 8 خلايا) بعد التخصيب في المختبر (IVF). يسمح هذا الإجراء لاختيار الأجنة تتأثر على أن يتم تحويلها إلى الرحم، وربما، لذلك، توفر ميزة تجنب إنهاء المحتملة من الحمل. ومع ذلك، إجراءات مثل PGD ليست دون قيود لأنها قد لا تزال تتطلب التشخيص قبل الولادة مؤكد تبعا احتياجات أو طلبات الطبية للزوجين. وعلاوة على ذلك، فإن عملية PGD يتطلب استخدام التلقيح الاصطناعي بغض النظر عن حالة الخصوبة للزوجين (أي، ينطبق أيضا على الأزواج دون القضايا العقم)، والتلقيح الاصطناعي قد لا تؤدي دائما إلى حمل ناجح. وأخيرا، فإن التكنولوجيا أو الخبرة قد لا تكون متاحة بسهولة في الموقع الجغرافي للزوجين. عوامل مختلفة، سواء الطبية والشخصية، ويجب أن يكون وزنه في اتخاذ القرار للاستفادة من التشخيص قبل الولادة أو PGD. ويمكن أن تشمل الاعتبارات الطبية عوامل مثل العمر من ظهور السرطان، انتفاذ، شدة أو ما يرتبط بها من المراضة والوفيات من السرطان وراثية، وتوافر وسائل الحد من مخاطر سرطان فعال أو علاج فعال. على الرغم من أن استخدام التشخيص قبل الولادة أو PGD راسخة نسبيا لاضطرابات وراثية شديدة مع انتفاذ عالية جدا، واستعمالها في الظروف المرتبطة مع انخفاض انتفاذ (على سبيل المثال، وسرطان الثدي وراثية أو متلازمة سرطان المبيض) لا تزال موضع جدل إلى حد ما من وجهة النظر الأخلاقية والتنظيمية على حد سواء. ويمكن أن تشمل الاعتبارات الشخصية عن قرار استخدام التشخيص قبل الولادة أو PGD المعتقدات الفردية الأخلاقية، ونظم القيم والمعتقدات الثقافية والدينية، فضلا عن العوامل الاجتماعية والاقتصادية. وبناء على نتائج المسوحات التي تعطى للنساء في كبير المجازفة لسرطان الثدي وراثي أو سرطان المبيض، ورأى 50٪ -75٪ من أفراد العينة بأن PGD كان خيارا مقبولا للفرد ذات المخاطر العالية بعد فقط حوالي 14٪ -33٪ ستنظر تمر PGD أنفسهم (28) . الأهم من ذلك، اقترحت الدراسات الاستقصائية أن غالبية النساء ذات المخاطر العالية لديهم معرفة ضئيلة أو معدومة من PGD، وتسليط الضوء على الحاجة إلى تحسين الوعي والتثقيف فيما يتعلق بخيارات الإنجابية المحتملة. وقد تم الإبلاغ عن ولادة ناجحة مع استخدام PGD وأطفال الأنابيب في BRCA1 / 2 حاملات التحور، ولكن لا تزال البيانات في الكتابات المنشورة محدودة للغاية. وبالإضافة إلى ذلك، البيانات المتعلقة بالسلامة أو نتائج الاستنساخ PDG وساعدت في المدى الطويل BRCA حاملات التحور غير متوفرة حتى الآن.
نونبوليبوسيس سرطان القولون وراثي (HNPCC) أو متلازمة لينش
وهو مرض وراثي جسمي قاهر الموروثة من عدم تطابق نظام إصلاح الحمض النووي. العديد من السلطات تشير إلى HNPCC باسم متلازمة لينش، معتبرا أن فشل HNPCC الاعتراف بشكل كاف على أهمية الأورام الخبيثة extracolonic، مثل بطانة الرحم، والمبيض، والجهاز الهضمي العلوي، وسرطان المسالك البولية المرتبطة بهذا المرض. تمثل هذه المتلازمة لمدة 5-10٪ من جميع سرطانات القولون والرحم (29) . تحليل الربط بين العائلات ذات الخطورة العالية أدت إلى اكتشاف أن متلازمة لينش والتي تسببها طفرات الجرثومية سطر في فئة من الجينات المسؤولة عن إصلاح أنواع معينة من الطفرات الحمض النووي (29) . وتسمى هذه الجينات "إصلاح عدم تطابق" الجينات وتؤدي إلى البروتينات التي تدقيق الحمض النووي وتصحيح الأخطاء التي يتم إجراؤها أثناء عملية طبيعية من النسخ المتماثل. MSH2 (MutS homolog 2) و MLH1 (MutL L homolog 1) هي عدم تطابق معظم تحور عادة إصلاح الجينات في هذه المتلازمة. MSH2 و MLH1 تقع على الكروموسومات 2p16 و3p21، على التوالي. الطفرات الجرثومية سطر في غيرها من الجينات إصلاح عدم تطابق ( MSH6 ، PMS1 ، و PMS2 تم تحديدها)، ولكن في أدنى تردد (29)) .
احتمال تطوير سرطان إذا كان هناك جرثومة سطر MLH1 أو MSH2 الطفرة:
| Cancer Type | Risk at Age 70 (%) |
| Colorectal carcinoma | 80 |
| Endometrial carcinoma | 42 |
| Gastric carcinoma | 19 |
| Biliary tract carcinoma | 18 |
| Urinary tract carcinoma | 10 |
| Ovarian carcinoma | 10 |
تاريخ الأسرة هي الخطوة الأولى في تحديد ما إذا كان المريض هو في خطر متزايد لمرض وراثي. وقد وضعت عدة معايير صارمة نسبيا لتحديد الأفراد المعرضين لمخاطر عالية لمتلازمة لينش. وحوالي 30٪ من الأسر المستوفية لمعايير بيثيسدا و50-92٪ من الأسر المستوفية لمعايير أمستردام لديها جرثومة سطر الحمض النووي عدم تطابق إصلاح تحور الجين (31),(30) ، .
يبدو أن معايير بيثيسدا لHNPCC (انظر أدناه) ليكون الأكثر حساسية في توقع عدم تطابق الطفرات إصلاح في الأسر HNPCC (30). Any of the following:
- سرطان القولون والمستقيم أقل من 50 عاما؛
- وجود سرطان ذات الصلة HNPCC متزامن أو متبدل التوقيت، بغض النظر عن العمر (القولون والمستقيم، الرحم والمعدة والمبيض والبنكرياس والحالب والحوض الكلوي، القنوات الصفراوية، الغدة الدهنية والأمعاء الدقيقة)؛
- سرطان القولون والمستقيم مع ميزات نسيجية معينة في الفرد أقل من 60 سنة من العمر. الميزات: الخلايا الليمفاوية التسلل الورم، Crohn's مثل رد فعل لمفاوية، موسيني / الخاتم خاتم التمايز، أو نمط النمو النخاعي؛
- سرطان القولون والمستقيم في تشخيص واحد أو أكثر من أقارب الدرجة الأولى، القولون والمستقيم مع HNPCC ذات الصلة مع واحدة من التشخيصات التي تتم بمقتضى سن ال 50؛
- سرطان القولون والمستقيم في اثنين أو أكثر من الأولى أو من الدرجة الثانية الأقارب مع وجود ورم ذات الصلة HNPCC، بغض النظر عن العمر.
المعايير الثاني أمستردام (انظر أدناه) لHNPCC هي أكثر تحديدا (31). كل ما يلي:
- القولون والمستقيم سرطان و / أو سرطان بطانة الرحم أو سرطان الخلايا الانتقالية من الحالب أو الحوض الكلوي أو سرطان في الأمعاء الدقيقة في ثلاثة أشخاص على الأقل في نفس الأسرة؛
- واحد من المرضى هو أحد الأقارب من الدرجة الأولى من اثنين من المرضى الآخرين؛
- يحدث المرض في اثنين على الأقل من أفراد الأسرة الآخرين؛
- وقدم واحدة على الأقل من التشخيصات قبل سن ال 50؛
- يجب تأكيد التشخيص تشريحيا؛
- يتم استبعاد المرجلات غدومي.
HNPCC / متلازمة لينش بسيط أداة تقييم المخاطر
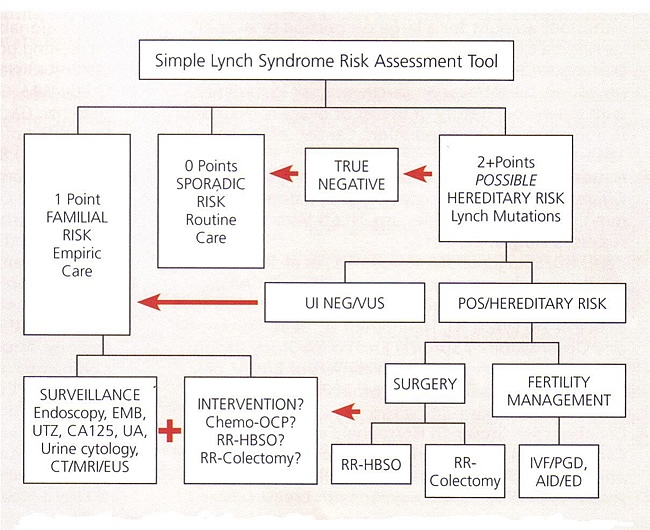
Abbreviations: AID, artificial insemination by donor; CA 125, cancer antigen 125; CT, computed tomography, ED, egg donation; EMB, endometrial biopsy; EUS, endoscopic ultrasound; HBSO, hysterectomy with bilateral salpingo-oophorectomy; IVF, in-vitro fertilization; MRI, magnetic resonance imaging; OCP, oral contraceptive pills; PGD, preimplantation genetic diagnosis; POS, positive; RR, risk-reducing; UA, urinalysis; UI NEG, uninformative negative; UTZ, ultrasound; VUS, variant of uncertain significance.
المراقبة سرطانات القولون وراثي نونبوليبوسيس (HNPCC)
عندما يتم تحديد الطفرات، وهو أبسط وأقل تكلفة، التحليل الجيني يمكن أن يؤديها على أفراد الأسرة الآخرين. ينصح المشورة واسعة النطاق قبل وبعد الاختبار. مرة واحدة وقد تم الانتهاء من عملية وراثية، ويمكن تعيين مخاطر الاصابة بالسرطان للمريض وأسرته. عندما تم التعرف على الطفرة، وينبغي أن تقدم الاختبارات الجينية لجميع أفراد الأسرة. يجب أن هؤلاء الأفراد الخضوع لكل الاستشارة الوراثية بحيث مزايا وعيوب اختبار يمكن تفسير. وتقدم شركات الطيران من طفرة مراقبة مكثفة. إذا تم تحديد أي طفرة في المريض، ولكن الأسرة تتلائم مع أمستردام بروتوكول لمتلازمة لينش، وينبغي أن يلاحظ المراقبة. وقد تبين من وفيات سرطان القولون والمستقيم في هذه المجموعة إلى يمكن خفضها من خلال فحص تنظير القولون (32) . ويعتقد معظم السلطات أن خطر الحد من استئصال الرحم مع الثنائية البوق و المبيض لها دور في إدارة هؤلاء المرضى. سرطان القولون والمستقيم في متلازمة HNPCC لديهم ميل ليحدث في القولون الداني، نسبة إلى حالات متفرقة، والتي هي في كثير من الأحيان البعيدة. فمن المستحسن استئصال القولون الوقائي للمرضى الذين يعانون طفرة HNPCC ومنهم من يتم تحديد الاورام الحميدة في سن مبكرة، وأيضا للمرضى الذين لديهم الاورام الحميدة التي هي الصغرية عدم الاستقرار إيجابية أو أولئك الأفراد الذين لا يستطيعون الخضوع لمراقبة منتظمة. الوقاية الكيماوية باستخدام الأدوية المضادة للالتهابات غير الستيرويدية في هذه المجموعة من المرضى لمنع الاورام الحميدة القولون هو حاليا قيد الدراسة، ويجب أن تكون البيانات المقبلة. إذا ويجري استكشاف هؤلاء المرضى لسبب آخر، ينبغي إيلاء الاعتبار لتقديم المشورة بشأن المخاطر والمنافع الناتجة عن استئصال الرحم الكلي مع الثنائية البوق و المبيض ممكن.
| Tumor Site | Screening Modality (%) |
| Colon | Colonoscopy every 1-2 years starting at ages 25-30 |
| Endometrium | Ultrasonography every 1-2 years starting at ages 30-35; consider endometrial biopsy every 1-2 years |
| Ovary | Ultrasonography and CA 125 annually, starting at ages 30-35 |
| Upper urinary tract | Urine cytology every 1-2 years starting at ages 30-35 |
| Stomach | Gastroscopy every 1-2 years starting at ages 30-35, (when upper GI cancer occurs two or more times in a family) |
GI, gastrointestinal
متلازمة ليثيوم Fraumeni
ليثيوم Fraumeni متلازمة (LFS) يرتبط مع الطفرات في الجينات الجرثومية الكابتة للورم TP53 ، التي تتسبب في وجود استعداد وتوغل للغاية لتطوير الأورام اللحمية وكذلك الثدي في مرحلة مبكرة، والدماغ، قشرة الكظر، وأنواع أخرى من السرطان. الناس مع LFS ديهم مخاطر المطلقة لتطوير أي سرطان من حوالي 50٪ في سن 30 سنة و 90٪ قبل سن 60 عاما (34) . حساب LFS لمدة تصل إلى 1٪ من سرطان الثدي في الولايات المتحدة الأمريكية، وقد يكون مثل سرطانات النمط الظاهري مميزة، معربا عن مستقبلات هرمون محفز Her2 و. ويقدر دي نوفو طفرة تردد بنسبة 7٪ إلى 20٪، بحيث TP53 الاختبار قد يكون من المناسب للمرضى المحددة في حالة عدم وجود تاريخ عائلي بسرطان (34) .
أعراض Cowden
كاودن متلازمة (CS) ينقل زيادة التعرض لسرطان الثدي والغدة الدرقية، بطانة الرحم، وسرطان القولون، والورم العجائبي حميدة التي تؤثر على أجهزة متعددة. ذلك هو شرط وراثي جسمي قاهر المرتبطة الطفرات في الورم suppresser الجين PTEN . الأورام الخبيثة الجهاز التناسلي للمرأة هي مشتركة مع خطر٪ 5-10 من سرطان بطانة الرحم وخطر 25-50٪ من سرطان الثدي (42) . تشمل المظاهر الخارجية رأس كبير وحطاطات الحليمية على وجهه، الغشاء المخاطي للفم اللغات، والأطراف، والتي هي في كل مكان تقريبا من سن 30 عاما. خطر الاصابة بسرطان الثدي عمر هو 25-50٪، مع متوسط عمر التشخيص من 38-46 سنة (35) . مخاطر الحياة مرة لسرطان بطانة الرحم هو 5-10٪ (35) . تحور سلالة الجرثومية في PTEN يتم تحديد الجينات في حوالي 80٪ من المرضى تلبية معايير التشخيص السريري، وتقريبا نصفهم ليس لديهم تاريخ عائلي من CS. تردد ذكرت من CS هو 1 في 200،000، ولكن من المرجح نقصا في تشخيص (35) . المتكررة، والاورام الحميدة بطانة الرحم متعددة تنذر ارتفاع مخاطر الاصابة بسرطان الرحم لدى النساء مع CS. اكتمال رصد الأورام الخبيثة والنظر فيها استئصال الرحم بعد الإنجاب ما يبرره (42) .
وراثي منتشر متلازمة سرطان المعدة
ويرتبط منتشر متلازمة سرطان المعدة وراثي مع طفرات في CDH1 الجينات ويتميز مخاطر العمر 80٪ للإصابة بسرطان المعدة (36) . النساء مع CDH1 الطفرات قد تصل إلى مدى الحياة خطر 60٪ لتطوير سرطان الثدي مفصص، إلا أن انتشار CDH1 الطفرات في النساء اختيارها لسن مبكرة في بداية أو تاريخ عائلي للإصابة بسرطان الثدي مفصص منخفضة، وحوالي 1٪ (36) . بين الأسر التي لديها المعدة وسرطان الثدي منتشر مفصص، CDH1 يتم تحديد الطفرات في 25-50٪ (36) .
أعراض Peutz-Jeghers
بويتزجيغرز متلازمة (PJS)، الناتجة عن تغييرات في STK11 الجينات، ويتميز الاورام الحميدة الورم العابي في جميع أنحاء الجهاز الهضمي، مما يؤدي إلى الانغلاف وانسداد الأمعاء. STK11 1 الطفرات أنقل مخاطر متزايدة لسرطان الثدي، المبيض، عنق الرحم، والبنكرياس، والمعدة، والقولون سرطان، بالإضافة إلى أورام الحبل الجنس حميدة. خطر الاصابة بسرطان الثدي تصل إلى 8٪ بحلول سن 40 سنة و 32٪ قبل سن 60 عاما. نصف STK11 حاملات التحور تفتقر تاريخ عائلي من نقابة الصحفيين الفلسطينيين (37) .
1-الورم العصبي الليفي
1 (NF-1) الميزات الأورام الليفية العصبية الجلدية والأورام الخبيثة غمد الأعصاب الطرفية، صعوبات التعلم، وانتشار من 1 في 3،000 ولادة حية (38) . ذكرت دراسة حديثة من النساء مع NF-1 خمسة أضعاف خطر متزايد لتطوير سرطان الثدي قبل سن 50 عاما و 3 - لزيادة 4 أضعاف في خطر الاصابة بسرطان مدى الحياة (38) ..
النهوض بمستوى رعاية مرضى السرطان
كما أصبح الكشف عن السرطان وراثية أكثر توافرا، العديد من الأسئلة المحيطة المسؤولية، ظهرت إدارة المخاطر، وسلامة المرضى. كما هو الحال في جميع القضايا الطبية الشرعية، وهذه المجالات المثيرة للقلق تتعلق عموما إلى مستوى الرعاية، والوثائق، موافقة، توقعات المريض، والمتابعة. العديد من مقدمي يشعرون بأن فحص سرطان وراثي ليس مستوى الرعاية في مكتب الرعاية الصحية الأولية. ومع ذلك، هناك ثلاث نقاط التي تعتبر مهمة جدا للتذكر. ومن مستوى الرعاية للحصول على تاريخ شامل وكامل الأسرة وتحديثه على أساس روتيني. ومن مستوى الرعاية لإعطاء المرضى المعلومات المناسبة على أساس أن تاريخ العائلة حتى يتمكنوا من اتخاذ قرارات مدروسة بشأن الرعاية الطبية. وأخيرا، فمن مستوى الرعاية إلى بدقة وبشكل كامل سجل كل ما نوقش مع المريض. إذا كنت تلتزم بهذه النقاط الثلاث، ثم يبدو أن الكشف عن سرطان وراثي هو، في الواقع، ومعيار الرعاية.
وثائق: بمجرد الانتهاء من تحديد شخص الذي يناسب معايير الاختبارات الجينية، وكيف الكثير من الوثائق هو المطلوب؟ هل هي كافية لدينا حالة ملاحظتك: "المعلومات ذات الصلة الاختبارات الجينية نظرا" أو "كتيب معين؟" على الرغم من أنه من الجيد أن نرى خطتك موثقة، هو أكثر أهمية بكثير لمعرفة الأسباب الكامنة وراء الخطة. في هذا المثال، مذكرة موسعة مثل: "بناء على تاريخ العائلة، وتفهم الاختبارات الجينية أوصى المريض أنه إذا كان الاختبار هو إيجابي هناك زيادة كبيرة في مخاطر الإصابة بسرطان المبيض و / أو سرطان الثدي أو [خاص لينش سرطان متلازمة. كنت فحص ل] ". على الرغم من أننا نعرف أن ناقشنا مخاطر الإصابة بالسرطان، ويمكن للمريض تتعارض بسهولة ما لم يتم توثيقها في الرسم البياني بهم. قد يجادل المرضى أنه إذا فهموا المخاطر التي يتعرضون لها، فإنها بالطبع، قد وافقت على المحك. تتضمن نوعا من نظام تتبع في مكتبك من الحكمة. هذا يمكن أن تسمح لك لمتابعة مع المريض بعد أن تم الإشارة لتقديم المشورة الوراثية. دون هذا النوع من تتبع ومتابعة، وهي مسألة مثيرة للقلق يمكن أن تثار: "إذا شعرت أنه من المهم بما فيه الكفاية بالنسبة للمريض أن يكون هذا الاختبار، لماذا لم يكن من المهم بما فيه الكفاية بالنسبة لك لمعرفة ما إذا تم القيام بالفحص"
الموافقة المستنيرة: الموافقة المسبقة عن علم أو رفض يتعين معالجتها عند مناقشة عمليات تقييم المخاطر وراثي. عادة، تعاملت مع الموافقة المسبقة عن فقط مع إبلاغ المرضى من المخاطر المرتبطة الإجراءات الغازية. ومع ذلك، كان هناك توسعا في ما يتضمن الموافقة المسبقة عن الكافي. كجزء من الموافقة المسبقة عن الكافي يطلب منا الآن أن يقدم كل خيارات العلاج، جنبا إلى جنب مع مخاطر وفوائد كل خيار. ولذلك، إذا كنا لا تعطي المرضى المناسبة الخيار من الاختبارات الجينية (جنبا إلى جنب مع المخاطر والفوائد)، ونحن قد تكون وجدت لتكون مهملة على أساس موافقة ينبغي أن يكون هناك حدث السلبية. هذا هو المكان الذي قد يأتي رفض مطلعة في اللعب، وإذا كان المريض لا يريد أن يفعل ما يشعر موفر غير مناسبة، أو لم يتبع حتى مع الإحالة الاستشارة الوراثية عند المشار لها إلى واحد، وتوثيق رفضهم، أو عدم وجود متابعة الى أعلى، قد تكون في نهاية المطاف أكثر أهمية من توثيق موافقتهم. وثائق رفض مطلعة أن الطبيب قد فعلت ما هو من الحكمة، وأنه هو خيار المريض ليست من خلال متابعة. العديد من الدول لديها بعض العناصر من الإهمال المشترك، وهذا يمكن أن يذهب خطوة أبعد وتوثيق سبب رفض المريض، والخوف من نتيجة الاختبار، عدم الرغبة في فعل أي شيء حيال النتيجة، أو لأسباب مالية قد تكون جزءا من القرار المريض إلى رفض الاختبار.
في الوقت الحاضر، واحدة من الأسباب الرئيسية لحالات سوء الممارسة تنطوي على مسائل مع سرطان الثدي. عادة، تتضمن ادعاءات كل من تأخر التشخيص، وعدم تشخيص. ونحن نشهد الآن ادعاء الجديدة التي يتم يشار إليه على أنه فشل لدينا "واجب إبلاغ" أو "واجب لتحذير". كان من الممكن تنفيذ هذه تنتمي إلى الفشل في التعرف على المريض في خطر لسرطان وراثي لذلك كان من الممكن تنفيذها أن زيادة المراقبة لتشخيص السرطان في وقت سابق أو أن جراحة تقليل المخاطر أو وقائية. وهذه الأنواع من الحالات يكون من الصعب جدا، إن لم يكن من المستحيل، للدفاع دون وثائق صحيحة، بما في ذلك الوثائق من رفض المريض من الاختبار، والتوثيق من التفسير من مخاطر الإصابة بالسرطان محددة للغاية.
ملخص
ويقدر أن أكثر من 300،000 النساء في الولايات المتحدة لتحمل مخاطر عالية ورثت لتطوير سرطان الثدي والمبيض. مجموعة واسعة على نحو متزايد من الاختبارات الجينية المتاحة لتحديد المخاطر المريض، ولكن النتائج لا تزال غير حاسمة قد يثبت أو معقدة لتفسير. تقدم سرطان المهنيين علم الوراثة تقييم شامل للمخاطر، وتقديم المشورة، والتوصيات لإدارة المرضى والأسر التي لديها راثية للاصابة بسرطان الثدي والمبيض. كما المتخصصين في مجال صحة المرأة، وتقييم المخاطر وراثية هي مسؤوليتنا. وينبغي أن تكون مركزة السرطان تاريخ عائلي جزء من التقييم الأولي لجميع المرضى. وينبغي أن يرتكز الأنساب الأم والأب لتشمل على الأقل ثلاثة أجيال (المريض، والديها "، وجديها 'أجيال). معلومات عن عمر أفراد الأسرة في تشخيص وتفاصيل إضافية مثل سرطان الثدي في كلا الثديين هي مفيدة جدا. ينبغي أن يطلب التحديثات من تاريخ عائلي في الامتحانات السنوية حوالي بسبب الإضافات والتشخيصات الجديدة قد يغير توصية أولية بشأن الاختبارات الجينية. ينصح تقييم المخاطر الوراثية للمرضى الذين لديهم أكبر من فرصة 20-25٪ تقريبا من وجود راثية لسرطان الثدي وسرطان المبيض. النساء مع BRCA1 أو BRCA2 وينبغي أن تقدم الطفرات خطر الحد من التهاب البوق و المبيض قبل سن 40 سنة أو عندما الإنجاب كاملة. لتخفيض المخاطر الثنائية البوق و المبيض، يجب إزالة جميع الأنسجة من المبيضين وقناتي فالوب. يجب أن يتم تنفيذ التصور شامل للأسطح البريتوني مع غسل الحوض. كاملة، باجتزاء مسلسل من المبيضين وقناتي فالوب هو ضروري، مع الفحص المجهري لسرطان غامض.
المراجع
- Robson ME, Boyd J, Borgen PI, et al. Hereditary-breast cancer. Curr Probl Surg 2001;38(6):387-480
- Risch HA, McLaughlin JR, Cole DC, et al. Population BRCA1 and BRCA2 mutation frequencies and cancer penetrances: a kin-cohort study in Ontario, Canada. J Natl Cancer Inst 2006;98(23):1694-1706
- Dominguez FJ, Jones JL, Zabicki K, et al. Prevalence of hereditary breast/ovarian carcinoma risk in patients with a personal history of breast or ovarian carcinoma in a mammography population. Cancer 2005;104:1849-1853
- National Comprehensive Cancer Network. NCCN Guidelines: Genetic/Familial High-Risk Assessment: Breast and Ovarian Cancer. Available at: http://www.nccn.org/professionals/physician_gls/pdf/genetics_screening.pdf Accessed 7 December 2012
- Reedy M, Gallion H, Fowler JM, et al. Contribution of BRCA1 and BRCA2 to familial ovarian cancer: a gynecologic oncology group study. Gynecol Oncol 2002;85:255-259
- Gudmundsdottir K, Ashworth A. The roles of BRCA1 and BRCA2 and associated proteins in the maintenance of genomic stability. Oncogene 2006;25:5864-5874. (Level III)
- Venkitaramen AR. Cancer susceptibility and the functions of BRCA1 and BRCA2. Cell 2002;108:171-182. (Level III)
- Karlan BY, Berchuck A, Mutch D. The role of genetic testing for cancer susceptibility in gynecologic practice. Obstet Gynecol 2007;110:155-167
- Antoniou A, Pharoah PD, Narod S, et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet 2003;72:1117-1130. (Level III)
- Metcalfe KA, Lynch HT, Ghadirian P, et al. The risk of ovarian cancer after breast cancer in BRCA1 and BRCA2 carriers. Gynecol Oncol 2005;96:222-226. (Level II-3)
- Lakhani SR, Manek S, Penault-Llorca F, et al. Pathology of ovarian cancer in BRCA1 and BRCA2 carriers. Clin Cancer Res 2004;10:2473-2481. (Level II-3)
- Levine DA, Argenta PA, Yee CJ, et al. Fallopian tube and primary peritoneal carcinomas associated with BRCA mutations. J Clin Oncol 2003;21:4227-4227. (Level III)
- American College of Obstetricians and Gynecologists. ACOG Practice Bulletin. Hereditary breast and ovarian cancer syndrome. Number 103, April 2009
- National Comprehensive Cancer Network. Genetic/familial high-risk assessment: breast and ovarian. NCCN Clinical Practice Guidelines in Oncology. V.1.2008. Fort Washington (PA): NCCN; 2008. (Level III)
- Olivier RI, Lubsen-Brandsama MA, Verhoef S, et al. CA 125 and transvaginal ultrasound monitoring in high-risk women cannot prevent the diagnosis of advanced ovarian cancer. Gynecol Oncol 2006;100:20-26. (Level II-3)
- Whittemore AS, Balise RR, Pharoah PD, et al. Oral contraceptive use and ovarian cancer risk among carriers of BRCA1 or BRCA2 mutations. Br J Cancer 2004;91:1911-1915
- Rebbeck TR, Lynch HT, Neuhausen SL, et al. Prophylactic oophorectomy in carriers of BRCA1 or BRCA2 mutations. N Engl J Med 2002;346:1616-1622
- King MC, Marks JH, Mandell JB. The New York Breast Cancer Study Group. Breast and ovarian cancer risks due to inherited mutations in BRCA1 and BRCA2. Science 2003;302:643-646
- Kauff ND, Satagopan JM, Robson ME, et al. Risk-reducing salpingo-oophorectomy in women with a BRCA1 or BRCA2 mutation. N Engl J Med 2002;346:1609-1615
- Karlan BY. Defining cancer risks for BRCA germline mutation carriers: implications for surgical prophylaxis. Gynecol Oncol 2004;92:519-520. (Level III)
- Lu KH, Kauff ND. Does a BRCA mutation plus tamoxifen equal hysterectomy? Gynecol Oncol 2007;104:3-4. (Level III)
- Satagopan JM, Boyd J, Kauff ND, et al. Ovarian cancer risk in Ashkenazi Jewish carriers of BRCA1 and BRCA2 mutations. Clin Cancer Res 2002;8:3776-3781. (Level II-3)
- Eisen A, Luinski J, Klijn J, et al. Breast cancer risk following bilateral oophorectomy in BRCA1 and BRCA2 mutation carriers: an international case-control study. J Clin Oncol 2005;23:7491-7496
- Walsh T, Casadei S, Coats KH, et al. Spectrum of mutations in BRCA1, BRCA2, CHEK2, and TP53 in families at high risk of breast cancer. JAMA2006;295:1379-1388. (Level III)
- Rodriquez E, Domchek SM. The prevention of hereditary breast cancer. Semin Oncol 2007;34:401-405. (Level III)
- Kauff ND, Mitra N, Robson ME, et al. Risk of ovarian cancer in BRCA1 and BRCA2 mutation-negative hereditary breast cancer families. J Natl Cancer Inst 2005;97:1382-1384. (Level II-3)
- Offit K, Kohut K, Claggett B, et al. Cancer genetic testing and assisted reproduction. J Clin Oncol 2006;24:4775-4782
- Offit K, Sagi M, Hurley K. Preimplantation genetic diagnosis for cancer syndromes: a new challenge for preventive medicine. JAMA 2006;296:2727-2730
- Lynch HT, Wastson P, Shaw TG, et al. Clinical impact of molecular and genetic diagnosis, genetic counseling, and management of hereditary cancer. Part I: Studies of cancer in families. Cancer 1999;86:2449-2456
- Hendriks YM, de Jong AE, Morreau H, et al. Diagnostic approach and management of Lynch syndrome (hereditary nonpolyposis colorectal carcinomas): a guide for clinicians. CA Cancer J Clin 2006;56:213-225
- Syngal S, Fox EA, Eng C, et al. Sensitivity and Specificity of clinical criteria for hereditary non-polyposis colorectal cancer associated mutations in MSH2 and MLH1. J Med Genet 2000;37:641-645
- Jarvinen HJ, Aarnio M, Mustonen H, et al. Controlled 15-year trial on screening for colorectal cancer in families with hereditary nonpolyposis colorectal cancer. Gastroenterology 2000;118:829-834
- Hampel H, Frankel W, Panescu J, et al. Screening for Lynch syndrome (hereditary nonpolyposis colorectal cancer) among endometrial cancer patients. Cancer Res2006;66:7810-7817
- Gonzalez KD, Buzin CH, Noltner KA, et al. High frequency of de novo mutations in Li-Fraumeni syndrome. J Med Gent 2009;46(10):689-693
- Zhou XP, Waite KA, Pilarski R, et al. Germline PTEN promoter mutations and deletions in Cowden/Bannayan-Riley-Ruvalcaba syndrome result in aberrant PTEN/ protein and dysregulation of the phosphoinsositol-3-kinase/Akt pathway. Am J Hum Genet 2003;73(2):404-411
- Schrader KA, Masciari S, Boyd N, et al. Germline mutations in CDH1 are infrequent in women with early-onset or familial lobular breast cancer. J Med Gent 2011;48(1):64-68
- Lim W, Olschwang S, Keller JJ, et al. Relative frequency and morphology of cancers in STK11 mutation carriers. Gastroenterology 2004;126(7):1788-1794
- Sharif S, Moran A, Huson SM, et al. Women with neurofibromatosis 1 are at a moderately increased risk of developing breast cancer and should be considered for early screening. J Med Genet 2007;44(8):481-484
- Pearlman MD. Ideal risk reduction management for women with BRCA gene mutations. Obstet Gynecol 2013;121:4-6
- Kwon JS, Tinker A, Pansegrau G, et al. Prophylactic salpingectomy and delayed oophorectomy as an alternative for BRCA mutation carriers. Obstet Gynecol 2013;121:14-24
- Mecalfe KA, Birenbaum-Carmeli D, Lubinski J, et al. International variation in rates of uptake of preventive options in BRCA1 and BRCA2 mutation carriers. Int J Cancer 2008;122:2017-2022
- Kalin A, Merideth MA, Regier DS, et al. Management of reproductive health in Cowden Syndrome complicated by endometrial polyps and breast cancer. Obstet Gynecol 2013;121:461-464
نشر: 1 May 2013
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


