Prise en charge clinique de l'endométriose
Bulletin WHEC pratique et directives cliniques de gestion pour les fournisseurs de soins de santé. Subvention à l'éducation fournie par la santé des femmes et Education Center (WHEC).
L'endométriose est une affection chronique et récurrente de reproduction avec les présentations cliniques variables. Gestion varie en fonction de l'âge du patient, les symptômes, l'étendue de la maladie, les objectifs en matière de reproduction, les risques de traitement, les effets secondaires, et des considérations de coût. Il est relativement fréquent chronique trouble gynécologique qui présente habituellement par des douleurs pelviennes chroniques ou de l'infertilité. La présence de viables, sensibles aux œstrogènes, de l'endomètre de type glandes et du stroma associés à une réponse inflammatoire en dehors de l'utérus est globalement appelée endométriose. Bien que neuf années se sont écoulées depuis qu'il a été décrit par Sampson, l'endométriose est toujours un désordre déconcertant en raison de ses diverses présentations cliniques et étiologiques controversées origines. Une fois que l'endométriose est diagnostiquée chez une femme en âge de procréer, il devrait être considéré comme une maladie chronique avec de multiples épisodes récurrents de douleurs, l'infertilité, et plus sans symptômes intervalles. Le coût annuel estimé pour le traitement de l'endométriose est plus de 20 milliards $. Trois sous-types de l'endométriose sont différenciées par l'inspection macroscopique et microscopique composé de endométriomes (kystes ovariens), superficielles implants endométriosiques (foyer de la maladie principalement sur le péritoine), et l'endométriose profonde infiltrant (nodules recto-vaginaux). Chaque forme peut avoir son propre étiologie ou les origines de partager avec les autres formes de cette maladie gynécologique chronique fréquente.
Le but de ce document est d'examiner les agents utilisés dans la gestion médicale de l'endométriose et de discuter de l'utilisation de technique de reproduction assistée (ART) pour les patients souffrant d'endométriose qui désirent une grossesse. L'étiologie, la relation entre l'étendue de la maladie et le degré des symptômes, l'effet sur la fertilité, et le traitement le plus approprié de l'endométriose demeurent incomplètes. Cette revue présente également les éléments de preuve, y compris les risques et les avantages, pour l'efficacité du traitement médical et chirurgical pour les femmes adultes qui présentent des symptômes de douleur pelvienne ou la stérilité ou les deux. Les plus récentes approches en utilisant la variété de disponibles traitements médicaux et chirurgicaux sont discutés car ils ont trait spécifiquement à la population adolescente. L'endométriose est une affection chronique relativement courante gynécologique qui présente habituellement par des douleurs pelviennes chroniques ou de l'infertilité. L'effet sociétal de ce trouble est énorme à la fois des coûts monétaires et la qualité de vie.
Incidence:
Cette maladie affecte énigmatique 6-10% des femmes âgées en matière de reproduction et a été trouvé chez les femmes entre les âges de 12 et 80 ans (1). L'âge moyen du diagnostic est d'environ 28 ans (2). Le taux de prévalence de 38% (intervalle, 20-50%) se trouve chez les femmes infertiles et dans 71-87% des femmes souffrant de douleurs pelviennes chroniques (3). Contrairement à beaucoup de spéculations, il n'ya pas de données à l'appui de la vue que l'incidence de l'endométriose est en augmentation, même si une meilleure reconnaissance des lésions d'endométriose peuvent avoir conduit à une augmentation du taux de détection. Il semble également y avoir aucune prédisposition particulière raciale à l'endométriose. Une association familiale de l'endométriose a été suggéré, et les patients avec un touché au premier degré ont à peu près de 7 à 10 fois le risque accru de développer une endométriose (4). L'héritage proposé est caractéristique d'un mécanisme polygénique-multifactorielle. Un certain nombre de polymorphismes génétiques ont été identifiées. Aux États-Unis, les coûts estimés de diagnostic de l'endométriose et le traitement de la douleur et l'infertilité associée totalisé 22 milliards de dollars en 2002 (7). Étant donné le taux de récidive connue pour l'endométriose au fil du temps, sans traitement médical, plus de femmes auront probablement leur voie vers l'endométriose progression de la maladie plutôt que la résolution. En outre, la sensation de douleur ne signifie pas nécessairement en corrélation avec l'identification des lésions. Les mécanismes responsables de l'expression des symptômes en cours sont les chances complexe et multifactoriel.
Physiopathologie:
La plupart des experts s'accordent à dire que la maladie est une étiologie multifactorielle. De longue date postulats comprennent menstruation rétrograde avec menstrue reflux implanter sur les structures pelviennes, cœlomiques pluripotentes cellules mésothéliales qui tapissent le péritoine subir une métaplasie dans le tissu de l'endomètre, et l'implantation des cellules à travers hématogène ou embolisation lymphatique. Toutefois, une énigme persiste: pourquoi la maladie se développe chez certaines femmes et dans d'autres elle ne fonctionne pas? Une meilleure compréhension des mécanismes moléculaires associés à l'endométriose a renforcé les théories traditionnelles. Les progrès récents concernant l'étiologie de l'endométriose doit être appliqué judicieusement dans la pratique clinique pour obtenir des résultats de traitement optimaux. Rétrograde tissu transplanté des cellules de l'endomètre et s'attachent aux surfaces péritonéales, établir un approvisionnement en sang, et d'envahir les structures avoisinantes (5). Ils sont infiltrés par les nerfs sensoriels, sympathiques, et parasympathique et induire une réponse inflammatoire. Implants endométriosiques sécréter l'estradiol (E2) ainsi que la prostaglandine E2 (PGE2), les agents qui attirent les macrophages (protéine chimiotactique des monocytes 1 [MCP-1]), des peptides neurotrophiques (facteur de croissance nerveuse [NGF]), des enzymes pour le remodelage des tissus (métalloprotéases matricielles [MMP]) et les inhibiteurs tissulaires des MMP (TIMP), et des substances pro-angiogéniques tels que le facteur de croissance endothélial vasculaire (VEGF) et de l'interleukine-8 (6) . Lésions sécrètent haptogobin, ce qui diminue l'adhérence des macrophages et de la fonction phagocytaire. Les lésions et les macrophages activés, qui sont abondants dans le liquide péritonéal chez les femmes atteintes d'endométriose, aussi sécréter des cytokines pro-inflammatoires (interleukine-1β, l'interleukine-8, l'interleukine-6, et facteur de nécrose tumorale α-[TNF-α]). Locale (et systémique) peut stimuler la production d'estradiol lésion de la PGE2, qui peut activer les fibres de la douleur, d'améliorer l'invasion des lésions neuronales en stimulant la production de neurotrophines NGF et d'autres, et de promouvoir la germination des nocicepteurs qui contribuent persistante douleur inflammatoire et inhiber l'apoptose neuronale. Facteur de saignement endomètre (EBAF) n'est pas correctement exprimés et peuvent contribuer à des saignements utérins. Infertilité résultats contre les effets toxiques du processus inflammatoire sur les gamètes et des embryons, altération de la fonction fimbriae, et de l'endomètre ectopique qui est résistant à l'action de la progestérone, et donc l'endomètre est inhospitalier pour l'implantation d'un embryon (7) . HOXA10 et HOXA11 gènes et avß3 de l'intégrine ne sont pas régulés à la hausse par la progestérone, et donc l'endomètre est inhospitalier pour l'implantation d'un embryon. Perturbateurs endocriniens peuvent contribuer à la résistance de la progestérone et peut-être un dysfonctionnement immunitaire (7) . ERFFI1 (inhibiteur des récepteurs ErbB rétroaction 1) est exprimée de façon constitutive et il ya excès de signalisation mitogénique.
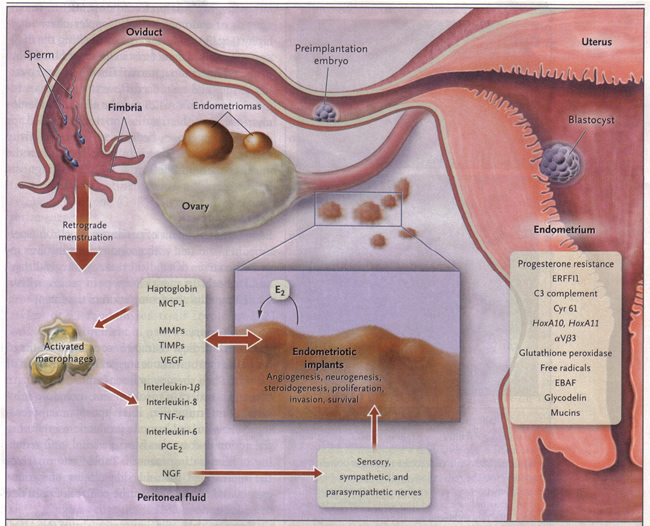
Figure 1. Physiopathologie de la douleur et l'infertilité associée à l'endométriose
Mécanisme de la douleur: De nombreuses études ont noté la présence de l'augmentation des cytokines pro-inflammatoires et des facteurs de croissance dans l'endométriose qui sont étroitement liées à la sensation de douleur (c.-à-facteur de croissance nerveuse, la prostaglandine, estradiol) (8) . Cela peut expliquer pourquoi l'endométriose minime peut toujours causer des douleurs importantes. Les données actuelles indiquent que l'endométriose est un état hyperalgique qui résulte de traitement de la douleur augmentée qui est dicté par la façon dont la moelle épinière et la douleur processus de cerveau à partir des lésions et d'autres informations sensorielles. Les fibres nerveuses périphériques qui fournissent lésions endométriosiques pourrait sensibiliser les neurones segment rachidien et finalement conduire à une sensibilisation du système nerveux central, entraînant une réaction exagérée du système nerveux central ou fantôme comme la douleur d'endométriose, ou les deux, malgré l'ablation des lésions (9) . Cette symptomatologie multidimensionnelle de bons de souscription d'endométriose stratégies de gestion multidisciplinaires.
Mécanisme d'hypofertilité: Les cas avancés de l'endométriose entraîne souvent des maladies graves adhésif qui pourrait poser une déficience évidente de la fécondité en réduisant tubo-ovarien motilité, ce qui empêche finalement pick-up de fonction. Que ce soit des formes plus douces de la maladie même causer subferility n'est pas certain. Les femmes stériles avec un minimum d'une endométriose légère avaient des taux sériques de antimullerian sur 3 jours que les patients infertiles présentant une obstruction des trompes (10) . Dans l'endométriose minime ou légère, le mécanisme biologique provoquant l'infertilité reste insaisissable. Une fois de plus, une meilleure réponse immunitaire peut être le coupable par altérations de la fertilité au début de la maladie au stade (11) . Un environnement hostile péritonéale peut conduire à la fonction des spermatozoïdes avec facultés affaiblies par l'avarie ADN de sperme de l'augmentation, et un cytosquelette compromise ovocytes. Une autre théorie attribue la responsabilité à un défaut endomètre basé sur les rapports de diminution de l'expression de plusieurs biomarqueurs de l'implantation. Malheureusement, l'endométriose est associée à un risque accru d'accouchement prématuré, de complications antepartum et de la prééclampsie.
Diagnostic et classification
Les manifestations cliniques de l'endométriose sont variables et imprévisibles à la fois dans la présentation et bien sûr. Dysménorrhée, douleurs pelviennes chroniques, la dyspareunie, nodularité ligaments utéro-sacrés, et d'une masse annexielle (soit symptomatique ou asymptomatique) sont parmi les manifestations bien connues. Un nombre significatif de femmes atteintes d'endométriose restent asymptomatiques. Le diagnostic définitif de l'endométriose ne peut être faite par l'histologie des lésions enlevées lors de la chirurgie. Ni les marqueurs sériques ni les études d'imagerie ont été en mesure de supplanter la laparoscopie diagnostique pour le diagnostic de l'endométriose. L'aspect histologique est constitué de glandes endométriales et le stroma avec des quantités variables de l'inflammation et la fibrose (12) .
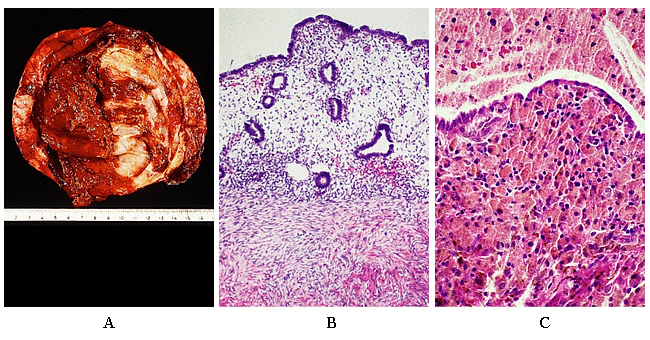
Figure 2. A: La surface intérieure d'un kyste dans un cas d'endométriose ovarienne. La couleur est généralement brune. B: L'endométriose ovarienne. Dans ce domaine, le tissu endométrial reproduit fidèlement l'aspect de l'endomètre normal, tant en termes de glandes et du stroma. C: aspect commun résultant d'une hémorragie répétée et l'accumulation de macrophages chargés d'hémosidérine-.
American Society for Reproductive Medicine; Classification révisée de l'endométriose
De nombreux systèmes de classification ont été proposés pour décrire l'endométriose par anatomique et de la gravité de la maladie. L'American Society for Reproductive Medicine (ASRM) de classification, qui est le système le plus couramment utilisé, a été révisé pour la troisième fois en 1996, mais a encore des limites (13) . Le système n'est pas un bon prédicteur de la grossesse après le traitement, malgré des ajustements aux résultats ponctuels et les points de découpage pour stade de la maladie. Le système de l'ASRM ne correspond pas bien avec les symptômes de la douleur et la dyspareunie ou l'infertilité. La valeur du système de l'ASRM révisé est en uniforme de l'enregistrement des constatations opératoires et peut-être pour comparer les résultats de diverses thérapies.
| Peritoneum | Endometriosis | <1 cm | 1-3 cm | >3 cm |
|---|---|---|---|---|
| Superficial | 1 | 2 | 4 | |
| Deep | 2 | 4 | 6 | |
| Ovary | R-Superficial | 1 | 2 | 4 |
| Deep | 4 | 16 | 20 | |
| L-Superficial | 1 | 2 | 4 | |
| Posterior cul-de-sac obliteration |
Partial / Complete | |||
| 4 | 40 | |||
| Ovary | Adhesions | <1/3 Enclosure |
1/3-2/3 Enclosure |
>2/3 Enclosure |
| R-Filmy | 1 | 2 | 4 | |
| Dense | 4 | 8 | 16 | |
| L-Filmy | 1 | 2 | 4 | |
| Dense | 4 | 8 | 16 | |
| Tube | R-Filmy | 1 | 2 | 4 |
| Dense | 4* | 8* | 16 | |
| L-Filmy | 1 | 2 | 4 | |
| Dense | 4* | 8* | 16 |
*if the fimbriated end of the fallopian tube is completely enclosed, change the point assignment to 16. Denote appearance of superficial implant types as red [(R), red, red-pink, flame-like, vesicular blobs, clear vesicles], white [(W), opacifications, peritoneal defects, yellow-brown], or black [(B), black, hemosiderin deposits, blue]. Denote percent of total described as R_%, W_%, and B_%. Total should equal 100%.
- Stage I (minimal) – 1-5;
- Stage II (mild) – 6-15;
- Stage III (moderate) – 16-40;
- Stage IV (Severe) – >40
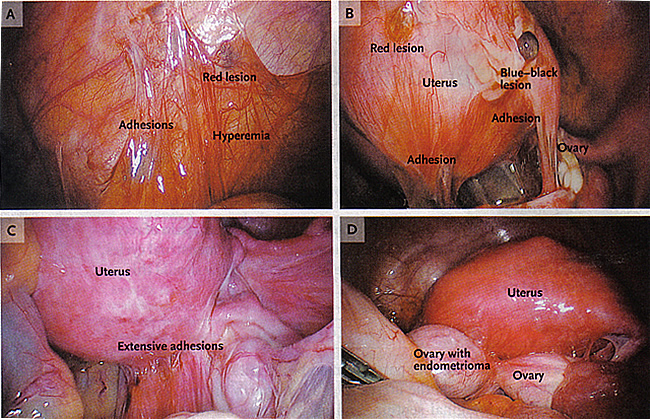
Figure 3. A: Affiche un implant endométriosique (lésion rouge), des adhérences, et hyperémie dans le péritoine. B: implants péritonéaux, y compris des lésions rouges et bleu-noir et des adhérences. C: adhérences étendues des effets de distorsion de l'anatomie normale du bassin. D: Un endométriome adhérente à l'utérus et extension postérieure de la capsule de l'ovaire.
Objectifs de gestion de l'endométriose
L'endométriose a plusieurs propriétés biologiques uniques. Il se comporte comme une maladie chronique et récurrente, car des implants microscopiques qui continuent à être actif après un traitement chirurgical. De nombreux patients ont une maladie quiescente avec des épisodes rares de la douleur, tandis que d'autres ont de fréquentes, de douleurs récurrentes. Ces types de symptômes différents sont souvent pas en corrélation avec la taille des lésions ou l'étendue de la maladie. Les approches actuelles pour la gestion de l'endométriose sont des symptômes orientée, visant principalement à traiter les douleurs pelviennes chroniques et l'infertilité. Protocoles de gestion peuvent également être ciblés à ralentir la progression de la maladie ou la prévention des récidives. Médicaux, chirurgicaux, ou une approche combinée peut être choisi. En outre, techniques de procréation assistée (ART) sont fréquemment utilisés pour traiter l'endométriose associée à l'infertilité. Les stratégies de traitement pour les femmes atteintes d'endométriose varient en fonction de l'âge du patient, les objectifs du traitement, la parité, l'étendue de la maladie, et le statut ménopausique. Pour les patients jeunes atteints de la maladie bénigne ne désirant pas d'enfants, il est conseillé d'utiliser la suppression médicale pour contrôler les symptômes et minimiser les interventions chirurgicales. Pour les femmes ayant une maladie grave qui désirent la fertilité, la chirurgie suivie par l'ART est une option raisonnable. Enfin, la gestion des patientes ménopausées chirurgicalement atteintes d'endométriose symptomatique nécessite une approche différente, dans laquelle l'utilisation hors AMM de nouvelles thérapies médicales, tels que les inhibiteurs de l'aromatase, peuvent être pris en considération.
Prise en charge médicale de l'endométriose-douleur associée
La douleur pelvienne chronique représente 10% des visites gynécologiques ambulatoires (14) . Un historique complet médical, chirurgical, social, et la famille devraient être obtenus chez des patients qui présentent ce symptôme, et ils devraient subir un examen physique qui comprend un examen pelvien. La douleur focale et de la tendresse à l'examen pelvien est associée à une maladie pelvienne dans 97% des patients et de l'endométriose dans 66% des patients (14) . La douleur pelvienne due à l'endométriose est généralement chronique (durée> 6 mois) et est associée à la dysménorrhée (50% à 90% des cas), la dyspareunie, douleur pelvienne profonde, et des douleurs abdominales basses, avec ou sans douleurs au dos et rein. La douleur peut se produire de façon imprévisible et intermittente tout au long du cycle menstruel ou il peut être continue, et il peut être sourde, lancinante, ou pointu, et exacerbée par l'activité physique. Vessie et des intestins des symptômes associés (nausées, ballonnement, et satiété précoce) sont généralement cyclique. La douleur s'aggrave souvent au fil du temps et peut changer de caractère; rarement, les femmes rapportent de brûlure ou d'hypersensibilité, des symptômes qui sont évocateurs d'une composante neuropathique. Les symptômes se confondent avec ceux de plusieurs pathologies gynécologiques autres (par exemple, maladie inflammatoire pelvienne, des adhérences pelviennes, les kystes ovariens ou des masses, léiomyome, et de l'adénomyose) et non-gynécologiques conditions et facteurs (p. ex syndrome du côlon irritable, les maladies inflammatoires de l'intestin, la cystite interstitielle, la douleur myofasciale , la dépression, et une histoire d'abus sexuel), rendant le diagnostic difficile. Actuellement, la méthode définitive pour diagnostiquer l'endométriose et mettre en scène et d'évaluer la récurrence de la maladie après traitement est la visualisation à la chirurgie. La laparoscopie diagnostique est couramment utilisé pour le diagnostic.
Traitement à long terme des patients souffrant de douleurs pelviennes chroniques associés à l'endométriose comporte des cours répétés de traitement médical, le traitement chirurgical, ou les deux. Dans la plupart des cas, la douleur revient au sein de 6 à 12 mois après la fin du traitement. Conservateur intervention chirurgicale est associée à une récidive de la douleur. Par conséquent, prise en charge médicale est couramment utilisé pour soulager les symptômes de cette maladie chronique. Il existe de nombreux randomisés contrôlés par placebo des études montrant la supériorité de ces médicaments par rapport au placebo (15) . Comme avec la chirurgie, il ya un «effet placebo» significative et la récurrence de la douleur après l'arrêt du traitement est élevé. Médicale un traitement suppressif n'influence pas la fertilité. Le principal le plus important à retenir est que la gestion médicale est efficace, mais que les symptômes ont tendance à récidiver rapidement après l'arrêt du traitement. Par conséquent, la première ligne de traitement médical devrait se concentrer sur les médicaments qui peuvent être utilisés dans le long terme (16) .
Médicaments utilisés pour le traitement de l'endométriose (16) :
| Class of Drugs | Drug | Dosage |
| Androgen | Danazol * | 100-400 mg orally twice a day 100 mg per vagina daily |
| Aromatase inhibitor | Anastrozole† Letrozole† |
1 mg orally daily 2.5 mg orally daily |
| Estrogen - progestin combinations | Monophasic Estrogen-progestin* |
Low ethinyl estradiol dose continuously |
| Gonadotropin - releasing hormone agonist (GnRH) | Goserelin*† Leuprolide depot*† Nafarelin*† |
3.6 mg SC monthly (10.8 mg IM every 3 mo) 3.75 mg IM monthly (11.25 mg IM every 3 mo) 200 mcg intranasally twice a day |
| Gonadotropin - releasing hormone agonist | Cetrorelix | 3 mg SC weekly |
| Progestin | Depo-subQ Provera 104* Dienogest‡ Etonogestrel-releasing implant Levonorgestrel-releasing IUS Medroxyprogesterone acetate Norethindrone acetate* |
104 mg/0.65 mL SC every 3 mo 2 mg daily 1 for 3 years 1 for 5 years 30 mg orally daily for 6 months, then 100 mg IM every 2 weeks for 2 months, then 200 IM monthly for 4 months 5 mg daily |
SC, subcutaneously; IM, intramuscularly; IUS, intrauterine system.
* FDA-approved for endometriosis.
†With add-back, i.e., norethindrone acetate 5 mg daily plus vitamin D 800 international units daily plus calcium 1.25 g daily.
‡Dienogest is a 19-nortestosterone derivative that is approved in the European Union for treatment of endometriosis. It is not available in the United States as a separate drug. It is available only in the oral contraceptive Natazia (Bayer HealthCare Pharmaceuticals; estradiol valerate/dienogest), which is a newer, four-phasic pack that contains dienogest.
Traitement chirurgical: Les approches chirurgicales pour soulager la douleur associée à l'endométriose peut être utilisé comme traitement de première ligne ou initiées après l'échec des traitements médicaux (17) . Les interventions chirurgicales comprennent l'excision, la fulguration, ablation au laser ou des implants d'endométriose sur le péritoine, l'excision ou le drainage ou l'ablation des endométriomes, la résection des nodules recto-vaginaux, la lyse des adhérences, et l'interruption des voies nerveuses. Études randomisées et contrôlées ont montré que moins de 6 mois, l'ablation des implants d'endométriose par laparoscopie est de 65% efficace pour réduire la douleur, par rapport à un taux de 22% de réduction de la douleur associée à la laparoscopie diagnostique seule (18) . Un petit essai comparant l'ablation laparoscopique au traitement agoniste de la GnRH ont montré une réduction des douleurs similaires avec les deux approches (19) . La récurrence de traitement de la douleur est commune exigeant (dans 30% à 60% des patients) dans les 6 à 12 mois après le traitement (19) . Une stratégie alternative pour le contrôle associée à l'endométriose douleur est l'interruption des voies nerveuses. Alors que l'ablation d'un segment du ligament utéro-sacré n'a pas prouvé son efficacité, randomisées et contrôlées ont démontré la supériorité de l'ablation laparoscopique de tissu endométriosique combiné avec neurectomie présacrée (ablation du faisceau du nerf dans les limites du triangle interiliaque) sur l'ablation laparoscopique seul dans l'amélioration de la dysménorrhée et la réduction de la douleur sévère ligne médiane (20) . Histoires de cas ont montré que l'hystérectomie avec salpingo-ovariectomie bilatérale fournie soulagement de la douleur dans 80% à 90% des femmes avec des symptômes débilitants qui étaient réfractaires à médicales ou autres interventions chirurgicales; douleur a été rapportée à se reproduire dans 10% des femmes au sein de 1 à 2 ans après la chirurgie (21) . Hormonal substitutif post-opératoire doit inclure à la fois un œstrogène et un progestatif, puisque l'œstrogène seul peut stimuler la croissance de la maladie microscopique.
Traitement médical adjuvant: Chez les femmes ayant une maladie avancée (stade III ou IV), modérée à sévère dysménorrhée, et non-cyclique des douleurs pelviennes, post-opératoire un traitement médical peut améliorer la gestion des douleurs en fournissant un contrôle de la maladie résiduelle microscopique ou récurrente. Une méta-analyse de six essais randomisés qui ont comparé 3 à 6 mois de traitement post-opératoire avec un agoniste de l'hormone libérant la gonadotropine (GnRH), le danazol, ou les contraceptifs oraux combinés avec l'absence de traitement post-opératoire d'un placebo a révélé une réduction significative des scores de douleur à la conclusion de la thérapie dans les groupes de traitement actif, bien que les avantages étaient incompatibles avec plus de suivi (18 mois) après l'arrêt du traitement (22) . L'intervalle moyen entre la chirurgie et la récurrence des symptômes nécessitant un traitement alternatif était significativement plus longue pour les patients ayant reçu un traitement post-opératoire avec agonistes de la GnRH (> 24 mois) que pour les patients ayant reçu le placebo (12 mois) (22) .
Gestion de l'endométriose-Associated infertilité
Même si les causes de l'endométriose associée à l'infertilité ou l'hypofertilité demeurent obscures, une chose est certaine, sous-fertiles les femmes ont l'endométriose à une plus grande prévalence, 20% -50%, que les femmes en âge de procréer ne cherche pas un traitement de fertilité (23) . Dans une étude sur des femmes stériles, l'incidence de la distribution a été étonnamment robuste pour un minimum-à-doux cas à 68%, tandis que les femmes modéré à grave de la maladie constitue les 32% restants (24) . Le système de classification actuel n'est pas utile pour prédire les taux de grossesse spontanées (16) . Le taux de fécondité mensuel pour les personnes ayant une endométriose est de 0.02 à 0,10 de 0,15 à 0,20 par rapport à des couples fertiles, bien que le taux n'est pas nécessairement plus faible que dans les patients avec hypofertilité inexpliquée (16) . Il n'existe aucune preuve d'une association avec une perte récurrente de grossesse. Grâce à la thérapie médicale sous la forme de la suppression ovarienne de stade I ou II endométriose n'améliore pas les taux de fécondité et ne devrait pas être offert (25) . En complément de traitement après la chirurgie laparoscopique pour le stade III ou IV avec l'endométriose GnRH ne semble pas être supérieure à l'expectative en termes de taux de conception naturelles au cours d'une de 5 ans la période de suivi dans un essai contrôlé randomisé (26) .
Le traitement chirurgical de l'endométriose liée à l'infertilité ne améliorer les taux de grossesse, mais l'ampleur de l'amélioration n'est pas claire. Excision de l'endométriome est plus efficace que le drainage simple et l'ablation de la paroi du kyste. Parce que la plupart des endométriomes peuvent être identifiés par l'échographie, le nombre de laparoscopies nécessaires pour obtenir des résultats est le même. Il est important dans toute intervention chirurgicale pour le retrait des endométriomes que le patient doit être informé que la chirurgie peut endommager l'ovaire et de réduire la réserve ovarienne (27) . La valeur de l'excision de l'endométriose profonde infiltrant uniquement pour améliorer la grossesse n'est pas claire et peut affecter la fertilité défavorable. Après la chirurgie initiale infructueuse pour l'endométriose associée à l'infertilité, la fécondation in vitro (FIV) est la meilleure option plutôt que de réintervention moins la douleur est toujours une question importante. Chirurgie ovarienne répétitive a été montré pour avoir un impact négatif significatif sur les résultats de FIV (27) . Traitement à la gonadotrophine et insémination intra-utérine, ainsi que la FIV, sont des traitements efficaces chez les femmes souffrant d'infertilité et l'endométriose (28). Dans un vaste essai randomisé comparant quatre stratégies de traitement chez 932 couples de stade I ou II endométriose ou une infertilité inexpliquée, les taux de grossesse cumulés au cours de quatre cycles de traitement étaient les suivants: l'insémination intra-cervicale (10%), l'insémination intra-utérine (18%), la thérapie et la gonadotrophine l'insémination intra-cervicale (19%), et de gonadotrophine thérapie et insémination intra-utérine (33%) (16), (29). Ablation de lésions d'endométriose avec lyse d'adhérences est recommandé pour le traitement de l'infertilité lié au stade de l'endométriose I ou II.
Grandes orientations de sociétés professionnelles pour le diagnostic et le traitement de l'endométriose douleur liée à l'infertilité et* (7), (21), (28):
| Condition | Recommendation |
| Pain† Diagnosis |
Surgery is preferred method for the diagnosis of pelvic pain and a pelvic mass (e.g. endometrioma), but it is not required before initiating empirical therapy, after consideration of other conditions in a differential diagnosis. There should be a low threshold for the evaluation of endometriosis in adolescents because the diagnosis is often missed in this age group. |
| Treatment | Initial treatment is a trial of non-steroidal anti-inflammatory drugs and hormonal therapy (combined oral contraceptives). All hormonal drugs that have been studied (combined oral contraceptives, progestins, GnRH agonists, and danazol) are similarly effective, but their side effects and costs differ. If a GnRH agonist is used, estrogen-progestin add-back therapy is recommended; GnRH agonists are not recommended for adolescents because of their effects on bone. The levonorgestrel intrauterine system is effective in selected patients. Laparoscopic uterosacral nerve ablation is not effective. |
| Infertility Diagnosis |
Both the male and female partner should undergo a full evaluation. |
| Treatment | Super-ovulation with intrauterine insemination provides benefit. Ovarian suppression is not effective in promoting spontaneous pregnancy. The use of GnRH agonist for 3-6 months before IVF and surgical ablation of endometriosis for stage I or II disease are beneficial. Excision of endometriomas >3cm in diameter is of benefit, although there is potential for diminished ovarian reserve. |
* Guidelines are from the American Society for Reproductive Medicine and the European Society of Human Reproduction and Embryology. GnRH denotes gonadotropin-releasing hormone; IVF denotes in-vitro fertilization.
†Data on the diagnosis and management of chronic pelvic pain and the treatment of adolescents with pelvic pain are from the American College of Obstetricians and Gynecologists.
La procréation assistée et l'endométriose
Lors du traitement de l'infertilité associée à l'endométriose, une approche par étapes est couramment utilisée. Gestion de l'endométriose associée à l'infertilité implique une combinaison de prise en charge expectative, la chirurgie, la stimulation ovarienne contrôlée (COS), l'insémination intra-utérine, et des techniques avancées de reproduction assistée (ART). L'utilisation de COS, avec ou sans insémination intra-utérine peut être bénéfique pour une courte durée de la thérapie chez les patients souffrant d'endométriose avec la perméabilité des trompes. Si COS ne donne pas lieu à une grossesse, la FIV est une étape prudente suivante. Si la chirurgie initiale ne parvient pas à restaurer la fertilité chez les patients atteints modérée (stade III) ou sévère (stade IV) associée à l'endométriose stérilité, la fécondation in vitro est une alternative efficace. Reproduction chez les patients asymptomatiques offre peu d'avantages ajouté quand il s'agit de l'infertilité (30) . Les patients souffrant d'endométriose semblent avoir la réponse ovarienne aux gonadotrophines réduite et ont besoin d'une dose plus élevée de gonadotrophines pour la FIV (30) . Il reste difficile de savoir si la présence ou le degré de l'endométriose est associée à la qualité des ovocytes avec facultés affaiblies ou la fécondation et le taux d'implantation (31) . L'effet de la chirurgie d'endométriose sur le résultat de cycles de FIV ultérieures a été étudiée, et des analyses de régression ont montré que l'intervalle de temps entre la chirurgie et la récupération des ovocytes n'affecte pas les taux d'implantation chez les patients subissant une FIV endométriose (32) .
L'endométriose chez les adolescents
De rares cas d'endométriose chez les patients premenarchal ont été décrits, mais l'âge moyen lors de la présentation de l'endométriose est de 15,9 ans (33) . Environ 70% des adolescents souffrant de douleurs pelviennes qui ne répondent pas au traitement médical classique ont l'endométriose (33) . La plupart des cas chez les adolescents peut être diagnostiquée sur la base de l'histoire et l'examen physique. Les symptômes évocateurs d'endométriose qui se traduisent par un diagnostic présumé inclure constante d'une douleur cyclique, la dysménorrhée, menstruations irrégulières, et la dyspareunie profonde. La douleur est habituellement sévère, perturbateur, et interfère avec l'école, les sports et autres activités sociales. L'examen physique d'un adolescent à l'endométriose peut varier d'un examen normal à la tendresse pelvienne généralisée ou persistante masse annexielle. Le constat classique de l'endométriose pelvienne est un utérus rétroversé fixe avec des cicatrices et postérieure de tendresse à l'utérus. La caractéristique des nodules ligaments utéro-sacrés et cul-de-sac peut être palpé sur l'examen rectovaginal dans environ un tiers des femmes atteintes de la maladie. Les ovaires peuvent être élargie et tendre et sont souvent fixés aux ligaments larges ou latérale paroi pelvienne. Le diagnostic définitif est fait par la visualisation laparoscopique des lésions d'endométriose. Les adolescents ont généralement des lésions claires, rouge, blanc et jaune-brun plus fréquemment que les lésions noires ou bleu.
Prise en charge médicale: non-stéroïdiens anti-inflammatoires non stéroïdiens (AINS) et d'autres analgésiques peuvent être utilisés pour diminuer la douleur associée à l'endométriose. Les AINS agissent pour limiter la production de prostaglandines, qui sont produites en excès dans les implants d'endométriose. Ils ont également pour fonction de perturber le mécanisme de rétroaction positive qui concerne la production locale de prostaglandines qui est responsable de plus de plus en plus les niveaux d'oestrogène dans les cellules endométriales ectopiques (34) . Le résultat est une diminution de la production d'oestrogènes, mais aussi une diminution de la réponse inflammatoire. Les pilules contraceptives orales (OCP) sont classiquement traitement de première ligne chez les adolescents en raison de la faible profil d'effets secondaires et des avantages secondaires de la prévention de la grossesse non désirée. OCP diminuer la paroi de l'endomètre et donc diminuer la quantité de tissu qui produit des prostaglandines. OCP doit être prescrit comme un processus continu, non cyclique régime. Cela diminuera les saignements de retrait nombre, minimisant ainsi l'apparition de symptômes. Alternativement, OCP peut induire une aménorrhée, ce qui entraîne une régression ultérieure des symptômes. Le traitement par OCP est suppressif, mais pas curatif (35) .
Agents de progestérone comprennent l'acétate de médroxyprogestérone par voie orale ou de dépôt, par voie orale 19-nortestostérone dérivés tels que l'acétate de noréthindrone et le norgestrel, et levonorgesterol de libération de dispositif intra-utérin. Ces agents de limiter la production d'œstrogènes, décidualisation cause de tissu endométrial ectopique, et par la suite entraîner une atrophie des cellules endométriales. Le danazol diminue le volume de tissu endométrial ectopique en induisant l'état hyperandrogénique. Bien qu'il soit très efficace, les effets secondaires androgènes sont considérables et irréversibles. Agonistes de la GnRH créer une hypo-œstrogéniques, l'environnement et hypogonadique ultérieure régulation à la baisse de la sécrétion de gonadotrophines entraînant la production d'œstrogènes diminue. Les effets secondaires qui limitent l'utilisation des agonistes de la GnRH sont les bouffées de chaleur, insomnie, diminution de la densité osseuse. Add-back thérapie avec de l'acétate de noréthindrone est recommandé d'éviter de graves séquelles à long terme (36) . Médiatise la conversion de l'aromatase androstènedione en estrone et de la testostérone à l'estradiol (34), les (37) . Inhibiteurs de l'aromatase de bloquer l'oestrogène locale produite par les tissus endométriosiques, détruisant ainsi le point focal de feed-back pour la croissance endomètre ectopique. Bien qu'il n'existe pas d'essais randomisés contrôlés comparant inhibiteurs de l'aromatase à la thérapie médicale traditionnelle pour l'endométriose, des études pilotes en utilisant des inhibiteurs d'aromatase avec add-back progestatifs ou OCP ont montré une réduction significative de l'endométriose associée à des douleurs pelviennes (37) .
Traitement chirurgical: Seul un traitement conservateur, dans lequel les organes reproducteurs sont conservés est indiquée chez les adolescents. La résection chirurgicale de la maladie visible peut être accomplie par des techniques d'excision, la fulguration, et l'ablation. Selon l'emplacement, la profondeur de l'invasion, et le degré de cicatrisation et l'inflammation, les techniques polyvalents sont applicables. Conservation de la capacité de reproduction est primordiale dans la population adolescente. L'ablation de l'endomètre dépôts diminue la douleur, avec ou sans ablation du nerf laparoscopique utérine. Présacrée neurectomie, une procédure dans laquelle les nerfs sympathiques de l'utérus sont divisés, peut diminuer la ligne médiane des douleurs abdominales. L'ablation de cellules endométriales ectopiques peuvent également augmenter la fertilité future chez les adolescents souffrant d'endométriose.
L'endométriose affectant non les organes reproducteurs
Endométriose extra-pelvienne a été rapportée dans une variété de sites, y compris le haut de l'abdomen, le diaphragme, la paroi abdominale (en particulier l'ombilic), le périnée (la cicatrice épisiotomie), et le thorax (38) . Les sites distants de l'endométriose, comme dans le poumon, l'avant-bras, la cuisse, la colonne vertébrale, et le nez ont également été rapportés (39). Peut-être que cela résulte de la transplantation hématologique ou lymphatique de cellules endométriales. En fait, 30% des femmes atteintes d'endométriose souffrent de la maladie dans les ganglions lymphatiques pelviens (39) . Le développement actuel de l'endométriose dépend probablement de plus d'un mécanisme d'origine. En outre, l'endométriose peut envahir toute l'épaisseur du rectum, du côlon, grandes et petites, les uretères, la vessie. Les symptômes qui sont associés à l'endométriose sur ces sites varie en fonction de l'emplacement et la profondeur de l'infiltration et notamment les femmes ayant des épisodes cycliques de hématurie macroscopique, hemtochezia, et une hémoptysie. Bien qu'un certain nombre d'approches thérapeutiques ont été utilisées pour les femmes atteintes d'endométriose extra-pelvienne présumée, l'efficacité rapportée de la suppression ovarienne avec un agoniste de la GnRH semble le soutenir en tant que traitement de première ligne, sauf en cas d'obstruction de l'uretère ou de l'intestin, qui sont les meilleurs traités chirurgicalement (38) . Même dans certains cas, de l'endométriose recto-vaginale, traitement suppressif médical peut soulager la douleur (40) . Expérience avec la gestion de ces cas est limité à une série de cas, souvent à partir d'un seul centre.
À long terme de suivi
Les symptômes peuvent réapparaître chez les femmes, même après une hystérectomie et une ovariectomie. L'endométriose peut réapparaître dans un maximum de 15% des femmes si oui ou non les patients sont traités avec la thérapie d'oestrogène après une ovariectomie bilatérale (38) . Par conséquent, l'hormonothérapie par œstrogène n'est pas contre-indiqué après chirurgie définitive pour l'endométriose. Bien que le taux réel de récidive est inconnue, chez les patients présentant des symptômes récurrents qui subissent une intervention chirurgicale, lésions d'endométriose peut être démontrée. Le site le plus fréquent des lésions récurrentes est le gros intestin et les petits (39) . Ces lésions étaient probablement présents au moment de la chirurgie et non excisées. Ces lésions peuvent être considérés comme une maladie persistante maladie plutôt récurrente. Persistance de la maladie dans les États hypo-œstrogéniques est probablement dû à l'expression locale d'activité de l'aromatase. Le traitement est difficile et nécessite souvent une intervention chirurgicale. L'utilisation d'un agoniste de la GnRH dans cette situation de hypoestrogenemia ne semble pas être d'avantage. Inhibiteurs de l'aromatase peut être envisagé, mais ne sont pas uniformément efficace (41) .
Actuellement, il existe des données limitées sur le calendrier de la thérapie d'oestrogène après une hystérectomie avec salpingo-ovariectomie bilatérale pour l'endométriose. Il semble qu'il n'y ait aucun avantage, en termes de taux de récidive, dans un délai de traitement d'oestrogène après la chirurgie (42) . Il existe peu de données pour indiquer que l'hormonothérapie peut stimuler la croissance de l'ovaire résiduel ou tissu de l'endomètre après hystérectomie totale et une salpingo-ovariectomie, si toutes les maladies visibles a été enlevé (42) . Il est également une préoccupation quant à la possibilité d'œstrogènes induite par la transformation maligne dans les implants d'endométriose résiduelles. Cela a conduit certains fournisseurs de soins de santé de recommander l'ajout de routine d'un progestatif à l'œstrogénothérapie. Cependant, il n'existe aucune preuve fondée sur les résultats à l'appui de cette recommandation. Chez les femmes ayant une ménopause chirurgicale ou spontanée avec un utérus intact, le traitement progestatif est nécessaire si l'œstrogène est administré. Il semble y avoir un risque accru de cancer de l'ovaire chez les patients d'endométriose, mais il n'est pas évident par ce que l'ampleur. Il a récemment été rapporté d'avoir un ratio des taux de 1,6 (intervalle de confiance 95% 1.12 à 2.9) (43) . Toutefois, des précurseurs tels que atypie cytologique ou histologique sont rares (44).
Résumé
De nombreux traitements médicaux sont disponibles pour traiter l'endométriose. Les données actuelles sont insuffisantes pour soutenir la supériorité d'un traitement plutôt qu'un autre. Il est important de tenir compte des préférences du patient dans l'approche de traitement et de fournir des conseils appropriés sur les risques, effets secondaires, et les coûts, parce que l'endométriose est une maladie chronique qui nécessite un traitement à long terme. Médicale un traitement suppressif améliore les symptômes de la douleur, mais les taux de récidive sont élevés après l'arrêt du traitement. Il est significatif à court terme une amélioration de la douleur après le traitement chirurgical conservateur, mais, comme avec prise en charge médicale, il ya aussi un taux important de récidive des douleurs. Ni un traitement médical ni chirurgical de façon permanente à soulager les symptômes associés à l'endométriose. Les traitements par association impliquant laparoscopie diagnostique et thérapeutique avec prise en charge médicale sera probablement fournir les résultats les plus optimaux. Différents rapports montrent des taux de récidive allant de 16% à 52%. Ces taux peuvent être différents en raison des protocoles de traitement variables, différentes méthodes de diagnostic de cette récidive et incompatibles de suivi. Évaluations intervalle régulier sont recommandés pour traiter la nature chronique de l'endométriose. En raison de la nature chronique de la maladie et l'impact sur la fertilité future, le soutien psychosocial est extrêmement important pour cette population de femmes. Le traitement chirurgical de l'endométriose liée à l'infertilité ne améliorer les taux de grossesse, mais l'ampleur de l'amélioration n'est pas claire. Excision d'un endométriome est supérieure à un drainage simple et l'ablation de la paroi du kyste. Lorsque soulagement de la douleur d'un traitement par agoniste de la GnRH soutient la poursuite du traitement, l'ajout de l'add-back thérapie réduit ou élimine la GnRH induit par un agoniste de perte minérale osseuse et procure un soulagement symptomatique, sans réduire l'efficacité de soulagement de la douleur. Lorsque le traitement médical a échoué, l'objet d'un traitement chirurgical définitif est approprié à ceux qui ne désirent pas la fertilité future.
Références
- Giudice LC, Kao LC. Endometriosis. Lancet 2004;364:1789-1799
- Kennedy S, Bergqvist A, Charon C, et al. ESHRE Special Interest Group for Endometriosis and Endometrium Guideline Development Group. ESHRE guideline for the diagnosis and treatment of endometriosis. Hum Reprod 2005;20:2698-2704
- Balasch J, Creus M, Fabregues F, et al. Visible and non-visible endometriosis at laparoscopy in fertile and infertile women and in patients with chronic pelvic pain: a prospective study. Hum Reprod 1996;11:387-391. (Level II-3)
- Bedaiway MA, Falcone T, Mascha EJ, et al. Genetic polymorphism in the fibrinolytic system and endometriosis. Obstet Gynecol 2006;108:162-168. (Level II-2)
- Giudice LC, Swiersz LM, Burney RO. Endometriosis. In: Jameson JL, DeGroot LJ, eds. Endocrinology. 6th ed. New York: Elsevier, 2010:2356-2370
- Bulun SE. Endometriosis. N Engl J Med 2009;360:268-279
- Giudice LC. Endometriosis. N Eng J Med 2010;362(25):2389-2398
- Lebovic DI, Mueller MD, Taylor RN. Immunobiology of endometriosis. Fertil Steril 2001;75:1-10
- Stratton P, Berkley KJ. Chronic pelvic pain and endometriosis: translational evidence of the relationship and implications. Hum Reprod Update 2011;17:327-346
- Lemons NA, Arbo E, Scalco R, et al. Decreased anti-Müllerian hormone and altered ovarian follicular cohort in infertile patients with mild/minimal endometriosis. Fertil Steril 2008;89:1064-1068
- Mansour G, Aziz N, Sharma R, et al. The impact of peritoneal fluid from healthy women and from women with endometriosis on sperm DNA and its relationship to the sperm deformity index. Fertil Steril 2009;92:61-67
- Walter AJ, Hentz JG, Magtibay PM, et al. Endometriosis: correlation between histologic and visual findings at laparoscopy. Am J Obstet Gynecol 2001;184:1407-1411; discussion 1411-1413. (Level II-3)
- Revised American Society for Reproductive Medicine classification of endometriosis: 1996. Fertil Steril 1997;67:817-821. (Level III)
- ACOG Practice Bulletin no. 51: chronic pelvic pain. Obstet Gynecol 2004;103:589-605
- Vercellini P, Crosignani P, Somigliana E, et al. “Waiting for Godot”: a commonsense approach to the medical treatment of endometriosis. Hum Reprod 2011;26:3-13
- Falcone T, Lebovic DI. Clinical management of endometriosis. Obstet Gynecol 2011;118:691-705
- Jacobson TZ, Duffy JM, Barlow D, et al. Laparoscopic surgery for pelvic pain associated with endometriosis. Cochrane Database Syst Rev 2009;4:CD001300
- Berkley KJ, Rapkin AJ, Papka RE. The pains of endometriosis. Science 2005;308:1587-1589
- Prentice A, Deary AJ, Goldbeck-Wood S, et al. Gonadotrophin-releasing hormone analogues for pain associated with endometriosis. Cochrane Database Syst Rev 2000;2:CD000346
- Proctor ML, Latthe PM, Farquhar CM, et al. Surgical interruption of pelvic nerve pathways for primary and secondary dysmenorrhea. Cochrane Database Syst Rev 2005;4:CD001896
- Idem. Treatment of pelvic pain associated with endometriosis. Fertil Steril 2008;90:Suppl:S260-S269
- Yap C, Funress S, Farquhar C. Pre- and post-operative medical therapy for endometriosis surgery. Cochrane Database Syst Rev 2004;3:CD003678
- Ozkan S, Murk W, Arici A. Endometriosis and infertility: epidemiology and evidence-based treatment. Ann N Y Acad Sci 2008;1127:92-100
- D’Hooghe TM, Debrock S, Hill JA, Meuleman C. Endometriosis and subfertility: is the relationship resolved? Semin Reprod Med 2003;21:243-254
- Hughes E, Brown J, Collins JJ, et al. Ovulation suppression for endometriosis. Cochrane Database Syst Rev 2007;3:CD000155
- Loverro G, Carriero C, Rossi AC, et al. A randomized study comparing triptorelin or expectant management following conservative laparoscopic surgery for symptomatic stage II-IV endometriosis. Euro J Obstet Gynecol Biol 2008;136:194-198
- Busacca M, Vignali M. Endometrioma excision and ovarian reserve: a dangerous relation. J Minim Invasive Gynecol 2009;16:142-148. (Level III)
- Practice Committee of the American Society for Reproductive Medicine. Endometriosis and infertility. Fertil Steril 2006;86:Suppl:S156-S160
- Barnhart K, Dunsmoor-Su R, Coutifaris C. Effect of endometriosis on in vitro fertilization. Fertil Steril 2002;77:1148-1155
- Mahutte NG, Arici A. Endometriosis and assisted reproductive technologies: are outcomes affected? Curr Opin Obstet Gynecol 2001;13:275-279
- Bedaiwy M, Shahin AY, AbulHassan AM, et al. Differential expression of follicular fluid cytokines: relationship to subsequent pregnancy in IVF cycles. Reprod Biomed Online 2007;15:321-325
- Bedaiwy MA, Falcone T, Katz E, et al. Association between time from endometriosis surgery and outcome of in vitro fertilization cycles. J Reprod Med 2008;53:161-165
- Laufer MR, Sanfilippo J, Rose G. Adolescent endometriosis: diagnosis and treatment approaches. J Pediatr Adolesc Gynecol 2003;163(3 Suppl):S3-S11
- Hartel Z. Dysmenorrhea in adolescents and young adults: etiology and management. J Pediatr Adolesc Gynecol 2006;19(6):363-371
- Doyle JO, Missmer SA, Laufer MR. The effect of combined surgical-medical intervention on the progression of endometriosis in an adolescent and young adult population. J Pediatr Adolesc Gynecol 2009;22(4):257-263
- Vercellini P, Fedele L, Pietropaolo G, et al. Progestogens for endometriosis: forward to the past. Hum Reprod Update 2003(9(4):387-396
- ACOG. ACOG Committee Opinion: Aromatase inhibitors in gynecologic practice. Obstet Gynecol 2008;112(2 Part 1):405-407
- ACOG Practice Bulletin. Management of endometriosis. Number 114, July 2010. Obstet Gynecol 2010;116:223-236
- Laufer MR. Current approaches to optimizing the treatment of endometriosis in adolescents. Gynecol Obstet Invest 2008;66 (Suppl 1):19-27
- Vercellini P, Somigliana E, Vigano P, et al. Surgery for endometriosis-associated infertility: a pragmatic approach. Hum Reprod 2009;24:254-269. (Level III)
- Bohrer J, Chen CC, Falcone T. Persistent bilateral ureteral obstruction secondary to endometriosis despite treatment with an aromatase inhibitor. Fertil Steril 2008;90:2004.e7,2004.e9. (Level III)
- Matorras R, Elorriaga MA, Pijoan JI, et al. Recurrence of endometriosis in women with bilateral adnexectomy (with or without total hysterectomy) who received hormone replacement therapy. Fertil Steril 2002;77:303-308. (Level I)
- Aris A. Endometriosis-associated ovarian cancer: a ten year cohort study of women living in the Estric Region of Quebec, Canada. J Ovarian Res 2010;3:2
- Bedaiwy MA, Hussein MR, Bicotti C, Falcone T. Pelvic endometriosis is rarely associated with ovarian borderline tumors, cytologic and architectural atypia: a clnicopathologic study. Pathol Oncol Res 2009;15:81-88
Publié: 25 June 2012
Dedicated to Women's and Children's Well-being and Health Care Worldwide
www.womenshealthsection.com


